
Будова свічки
Запаліть свічку. Ви побачите, що полум’я неоднорідне. У нижній, темній, частині полум’я температура невисока. Через нестачу повітря горіння тут майже не відбувається. Парафін, з якого виготовлено свічку, спочатку плавиться, а потім перетворюється
на газоподібні горючі речовини.
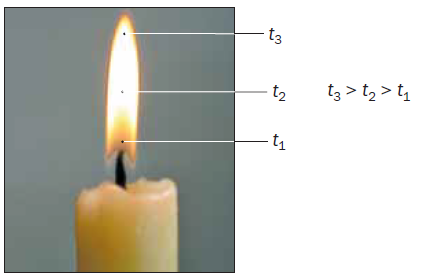
У середній частині полум’я температура вища. Тут частина речовин згоряє, а решта перетворюється на горючі гази і часточки сажі, які розжарюються і світяться. Тому ця частина полум’я найяскравіша. Доведіть наявність часточок сажі, помістивши в
середню частину полум’я порцелянові чашку або шпатель. Що спостерігаєте?
Верхня частина полум’я має найвищу температуру.
У ній усі речовини згоряють повністю; при цьому утворюються вуглекислий газ і водяна пара. Під час проведення хімічних дослідів нагрівати
речовини потрібно у верхній частині полум’я, детемпература найвища.
РЕЧОВИНА
Будь-який предмет, що має об`єм, масу, густину, температуру і інші властивості називають фізичним тілом. Або будь-які предмети навколо нас називають фізичними тілами, а матеріал, із якого вони складаються,— речовиною. Фізичне тіло може складатися з однієї чи кількох речовин (рис. 2.1). Наприклад, ложки, виделки — фізичні тіла, виготовлені здебільшого зі сталі. Столові прибори можуть бути також зроблені з порцеляни або срібла. Ніж, як правило, роблять не з однієї речовини, а з двох: лезо — зі сталі, руків'я — з дерева. А от для виробництва такого фізичного тіла, як мобільний телефон, використовують десятки різних речовин.
Агрегатні стани речовини. Відомо три агрегатні стани речовини — твердий, рідкий і
газоподібний.
Під час нагрівання більшість твердих речовин плавиться, а рідини закипають, перетворюючись на пару. При зниженні температури відбуваються зворотні перетворення. Гази зависокого тиску зріджуються. За усіх цих явищ атоми і молекули не руйнуються. Отже, речовина, змінюючи свій агрегатний стан, не перетворюється на іншу.
Атом
Атом — найменша частинка речовини, яка не має електричного заряду і складається з ядра і електронів, що рухаються навколо нього.
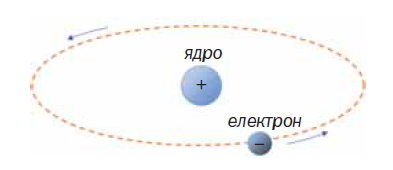
Ядра атомів заряджені позитивно, а електрони мають негативний заряд.
Атоми можуть відрізнятися один від одного за складом (наприклад, за кількістю електронів), а також за масою. Атомами утворена невелика кількість речовин. Серед них — графіт, алмаз, деякі мінерали, декілька газів.
Молекула — частинка речовини, яка складається з двох або більшої кількості сполучених атомів.
Газ водень складається з молекул, у кожній з яких міститься два однакових атоми. У молекулі води — три атоми; два з них однакові, такі самі, що і в молекулі водню, а третій — іншого складу
і майже в 16 разів важчий.

Чисті речовини і суміші.
У кожній речовині завжди міститься певна кількість домішок,
тобто інших речовин. Вони потрапляють до неї під час її добування, зберігання або використання. Речовину, в якій домішок дуже мало (наприклад, менше 1 г в 1 кг), прийнято вважати чистою. З такими речовинами працюють у науковій лабораторії, шкільному хімічному кабінеті. Чисті цукор і кухонну сіль ми використовуємо як харчові продукти.
Якщо вміст домішок у речовині істотний, тоді маємо суміш речовин. У природі дуже рідко
трапляються чисті речовини, а переважають суміші. Те саме стосується харчових продуктів, лікарських і косметичних засобів, товарів побутової хімії, будівельних матеріалів.
Кожну речовину, що міститься в суміші, називають компонентом.
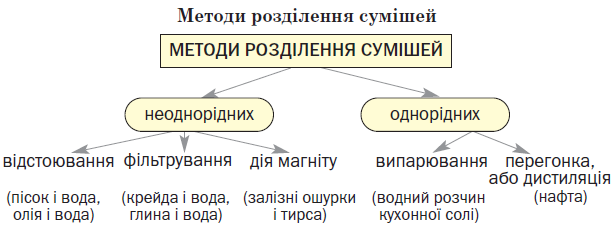
Існують однорідні й неоднорідні суміші.
Однорідні суміші. Додамо невелику порцію цукру в склянку з водою і будемо перемішувати, доки весь цукор не розчиниться. Рідина матиме солодкий смак. Отже, цукор не зник, а залишився в суміші. Проте його кристаликів ми не побачимо, навіть розглядаючи краплю рідини у потужний мікроскоп. Виготовлена суміш із цукру і води є однорідною (мал.); у ній рівномірно перемішані найдрібніші частинки (молекули) цих речовин.

Суміші, компоненти яких неможливо виявити спостере_
женням, називають однорідними.
Більшість металічних сплавів — також однорідні суміші. Так, у сплаві золота з міддю, який використовують для виробництва ювелірних прикрас, відсутні червоні часточки міді й жовті часточки золота.
Із матеріалів, що є однорідними сумішами речовин, виготовляють багато предметів різноманітного призначення. До однорідних сумішей належать усі суміші газів, у тому числі й повітря. Відомо чимало однорідних сумішей рідин. Така суміш утворюється при змішуванні, наприклад, спирту і води.
Неоднорідні суміші. Вам відомо, що крейда не розчиняється у воді. Якщо її порошок всипати у склянку з водою, то в утвореній суміші завжди перебуватимуть часточки крейди, які видно неозброєним оком.
Суміші, компоненти яких можна виявити спостереженням, називають неоднорідними.
До неоднорідних сумішей (мал.) належить більшість мінералів, ґрунт, будівельні матеріали, живі тканини, каламутна вода, молоко і чимало інших харчових продуктів, деякі лікарські й косметичні засоби.
Деякі суміші мають загальні назви. Неоднорідну суміш рідини і газу називають піною. Вона утворюється, наприклад, коли у склянку наливають із пляшки газований напій (компоненти піни — рідина і вуглекислий газ) або перемішують розчин прального засобу (компоненти піни — рідина і повітря). Добре струшену суміш двох рідин, які не розчиняються одна в одній, називають емульсією. Прикладом емульсії є молоко; його головні складові — вода і рідкі жири. Якщо перемішати рідину із нерозчинною в ній добре подрібненою твердою речовиною (наприклад, крейдою), то отримаємо суспензію. В атмосфері нерідко утворюються аерозолі — дим, туман.
У неоднорідній суміші фізичні властивості компонентів зберігаються. Якщо цукор змішати з борошном або крохмалем, то ці сумішітакож матимуть солодкий смак. Залізніошурки, змішані з мідними або алюмінієвими, не втрачають здатності притягуватися домагніту. Вода в суміші з піском, крейдою абоглиною замерзає за температури 0 °С і закипає за 100 °С.
Періодична система елементів Д. І. Менделєєва
У хімії, як і в кожній науці, систематизація фактичного матеріалу значно допомагає його вивченню. Можна сказати, що сучасна хімія починає свою справжню історію з відкриттям періодичного закону хімічних елементів, що належить великому російському вченому Д. І. Менделєєву. Цей закон і його графічне відображення – періодична система елементів – основа вивчення хімічних елементів.
Подивіться на періодичну систему Д. І. Менделєєва: кожному елементу відведена окрема клітинка у таблиці. Всі елементи пронумеровані. Періодична система відображає природну класифікацію елементів. Природний порядок елементів базується на кількості протонів у їхньому ядрі і починається елементом Гідрогеном. Елемент Гідроген містить у ядрі атома один протон, тому йому присвоєно порядковий номер один. Елемент номер два – Гелій містить у ядрі два протони. Елемент номер три – Літій містить у ядрі три протони. У кожного наступного елемента плавно збільшується по одному протону в ядрі.
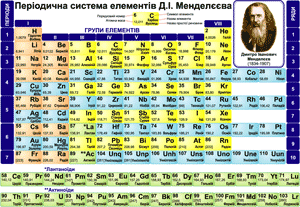
Кожний елемент посідає саме своє місце, тому, що номер хімічного елемента у періодичній системі дорівнює числу протонів у ядрі його атома.
Порядковий номер або протонне число – це число протонів у ядрі атома.
Елементи розмістили у ряди і стовпчики. У клітинці записано символ елемента, його порядковий номер, назву елемента, значення відносної атомної маси. У тих випадках, коли назви простих речовин утворених даним елементом і назви елемента різняться, наведено обидві назви.
Із періодичної системи ми будемо брати необхідні нам відомості про хімічний елемент.
Елемент має назву, хімічний символ і певний порядковий номер у періодичній системі хімічних елементів Д. І. Менделєєва.
Відносна атомна маса
Маси атомів усіх хімічних елементів хіміки порівнюють із значенням однієї а.о.м. і одержують відносні атомні маси. Для цього абсолютні значення атомних мас елементів ділять на числове значення атомної одиниці маси. Відносна атомна маса позначається символом Ar («а-ер»), де А – перша літера грецького слова «атомос» – «неподільний», r – перша літера латинського слова «relativus» – «відносний»:
Математичний вираз:
Відносна атомна маса – це фізична величина, що визначається відношенням маси атома елемента до 1/12 частина маси атома Карбону.
Приклад.
а) Визначимо відносну атомну масу Натрію:
ma(Na) = 3,8164 · 10–26 кг, тоді
Отже, Ar(Na) ≈ 23.
Прості речовини. Атоми здатні сполучатися з такими самими або іншими атомами. Це
зумовлює велике розмаїття у світі речовин.
Речовину, утворену одним хімічним елементом, називають простою речовиною.
Прості речовини поділяють на метали і неметали.
Метали, ці речовини мають багатоінших спільних властивостей. Метали за звичайних умов тверді (лише ртуть є рідиною), добре проводять електричний струм і теплоту, мають здебільшого досить високі температури плавлення (понад 500 °С). Вони пластичні; їх можна кувати, витягувати з них дріт. Атоми розміщені в металі дуже щільно, і частина електронів постійно
переходить від одних атомів до інших. Завдяки цим електронам метали проводять електричний струм, здатні швидко нагріватися й охолоджуватися.
Неметали. Простих речовин цього типу значно менше. До неметалів належать азот, кисень,
графіт, алмаз, сірка, йод та ін.Неметали відрізняються від металів передусім відсутністю металічного блиску. Лише графіт, йод, кристалічні бор і силіцій мають такий блиск. Неметали не проводять електричного струму (виняток — графіт). За звичайних умов частина неметалів перебуває в газоподібному стані (жодного металу-газу не існує), інші є твердими речовинами і тільки бром — рідиною.
Складні речовини. Сполучення атомів різних хімічних елементів породжує надзвичайно велику кількість відповідних речовин, у десятки тисяч разів більшу, ніж простих речовин.
Речовину, утворену двома або більшою кількістю елементів, називають складною речовиною, або хімічною сполукою.
Більшість складних речовин мають молекулярну будову. Тому температури їх плавлення
і кипіння невисокі. Частина таких речовин має запах.
Молекулярною сполукою є вода. Молекула води складається з двох атомів Гідрогену і
одного атома Оксигену. Молекулярну будову мають чадний і вуглекислий гази (обидва утворені Карбоном і Оксигеном), цукор, етиловий спирт, оцтова кислота (утворені Карбоном, Гідрогеном і
Оксигеном) та ін. Кількість атомів у молекулах складних речовин може бути різною —
від двох до сотень і навіть тисяч.

Хімічна формула — це позначення атома, молекули, речо_
вини за допомогою символів хімічних елементів та індексів.
Хімічною формулою атома є символ відповідного елемента. Наприклад, атом Алюмінію
позначають символом Al, атом Силіцію — символом Si. Такі формули мають і прості
речовини цих елементів (вони складаються з атомів) — метал алюміній, неметал силіцій.
Хімічна формула молекули простої речовини містить символ елемента і нижній індекс —
маленьку цифру, записану нижче і справа від символу. Індекс указує на кількість атомів
елемента в молекулі.
Молекула кисню складається з двох атомів
Оксигену. Її хімічна формула — О2. Цю формулу читають, вимовляючи спочатку символ
елемента, потім — індекс: «о_два». Формулою О2 позначають не лише молекулу, а й речовину кисень.
Із двох_томних молекул складаються також
прості речовини Гідрогену, Нітрогену, Флуору, Хлору, Брому, Йоду. В озоні містяться трьохатомні молекули, білому фосфорі — чотирьохатомні, а сірці — восьмиатомні.
У формулі молекули складної речовинизаписують символи елементів, атоми якихмістяться в ній, а також індекси. Молекулавуглекислого газу складається з одного атомаКарбону і двох атомів Оксигену. Її хімічнаформула — СО2 («це_о_два»). Запам’ятайте:якщо молекула містить один атом елемента,то відповідний індекс, тобто 1, у хімічній формулі не пишуть. Формула молекули вуглекислого газу є також формулою самої речовини.
Деякі хімічні формули містять круглі дужки. Індекс після дужок указує на кількість груп атомів, що записані в них. Так, у формулі Сa(OH)2 є дві групи атомів ОН, а Al(NO3)3 — три групи атомів NO3. Першу формулу читають «кальцій_о_аш_двічі» (але не «кальцій_о_аш_два»), другу — «алюміній_ен_о_три_тричі».
Відносна молекулярна маса — це відношення маси молекули до 1/12 маси атома Карбону.
Позначення відносної молекулярної маси — Мr. Ця величина, як і відносна атомна маса,
не має розмірності.
Сподіваємося, що очевидними для вас є такі твердження:
• відносні молекулярні маси пропорційні
масам молекул;
• співвідношення мас молекул такі самі,
що й відносних молекулярних мас.
Значно простіше розрахувати відносну молекулярну масу за відносними атомними масами.
Відносна молекулярна маса дорівнює сумі відносних мас атомів, які містяться в молекулі.
Знайдемо відносні молекулярні маси кисню і води, використавши округлені до цілих
чисел значення відносних атомних мас Оксигену і Гідрогену:
Мr(О2) = 2Ar(О) = 2 · 16 = 32;
Мr(H2О) = 2Ar(H) + Ar(О) = 2 · 1 + 16 = 18.
Масова частка елемента у сполуці — це відношення маси елемента до відповідної маси сполуки.
Зауважимо, що маси елемента і сполуки потрібно брати в однакових одиницях вимірю_
вання (наприклад, у грамах).
Масова частка не має розмірності. Її часто виражають у відсотках. У цьому разі формула
має такий вигляд:
Очевидним є те, що сума масових часток усіх елементів у сполуці становить 1 (або 100 %).
Розглянемо приклади розв’язування задач, які передбачають обчислення або використання масових часток елементів у сполуках.

Здатність атома сполучатися з певною кількістю таких самих або інших атомів називають валентністю.
Валентність є важливою властивістю атома; вона має кількісну характеристику.
Атом Гідрогену завжди сполучається з одним атомом. Якщо з таким самим, то утворюється молекула водню Н2, а якщо з іншим — утворюються молекули фтороводню HF, води H2O:
Гідроген — одновалентний елемент.
У молекулі фтороводню HF атом Флуору сполучений з одним атомом Гідрогену. Проаналізувавши кількісний склад інших сполук Флуору, легко дійти висновку, що цей елемент, як і Гідроген, є одновалентним. Атом Оксигену утримує в молекулі води два атоми Гідрогену. Оксиген — двовалентний елемент. Таку валентність Оксиген виявляє завжди — і в молекулі простої речовини (О2), і в молекулах складних речовин.
Значення валентності елемента за необхідності вказують римською цифрою над його
символом у хімічній формулі:
У математичних розрахунках і в тексті для цього застосовують арабські цифри.ИСНОВКИ