
Фізична хімія
Перший закон термодинаміки
Термодинаміка вивчає загальні закони взаємного перетворення енергії з однієї форми в іншу. Хімічна термодинаміка- це розділ фізичної хімії, що вивчає перетворення енергії в хімічних процесах, таких як хімічні реакції, розчинення, плавлення, випаровування, сублімація, поліморфні перетворення, з'ясовує принципову можливість самовільного протікання цих процесів.
У термодинаміці використовують поняття "термодинамічна система". Обмежена якимось чином частина фізичного світу, будь-який матеріальний об'єкт, умовно відокремлений від навколишнього середовища, називається термодинамічною системою. При взаємодії такої системи з навкіллям, вона може одержувати або віддавати енергію у вигляді теплоти (роботи). Наприклад, гарячий кусок металу (термодинамічна система) віддає тепло холодному. Обмін системи з навколишнім середовищем за рахунок дифузії призводить до рівномірного розподілу частинок по всьому об'єму системи. Якщо система не обмінюється з навколишнім середовищем ні речовиною, ні енергією, то вона називається ізольованою. Якщо система обмінюється з навкіллям тільки енергією, то вона називається закритою. У випадку, коли система обмінюється з навколишнім середовищем і речовиною, і енергією, то така система є відкритою.
Стан термодинамічної системи визначається фізичними характеристиками, так званими параметрами: т— маса, V — об'єм, р- тиск, Τ — температура, n— кількість речовини, С— теплоємність.
Якщо параметри з часом не змінюються, то система називається рівноважною.
При зміні параметрів системи змінюється її стан, тобто проходить термодинамічний процес. Процес при сталій температурі називається ізотермічним, при сталому тиску - ізобарним, при сталому об'ємі - ізохорним, а при відсутності обміну теплоти з навколишнім середовищем - адіабатичним.
Стан системи описується такими термодинамічними функціями: U- внутрішня енергія, Н– ентальпія, S- ентропія, G - вільна енергія Гіббса (ізобарно-ізотермічний потенціал), F- вільна енергія Гельмгольца (ізохорно-ізотермічний потенціал). Наведені термодинамічні функції є функціями стану системи.
Існують дві форми обміну енергією – теплота і робота.
Коли процес протікає при сталому тиску (ізобарний процес), то робота дорівнює:

або ж
де Ам- максимальна робота розширення; р- тиск; V— об'єм системи. Використавши рівняння Менделєєва-Клапейрона для одного моля газу pV = RT, отримаємо:
Тому робота розширення при ізобарному процесі розраховується за формулою:
Для n молів газу робота розширення дорівнює:
При ізохорному процесі ( ΔV = 0) робота розширення не виконується. Коли процес протікає за сталої температури (ізотермічний процес), робота розширення дорівнює:
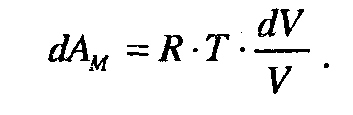
Звідси:

При адіабатичному процесі ( Т2 > Т1,) робота розширення виконується за рахунок зменшення внутрішньої енергії системи:
де Cv - теплоємність газу при сталому об'ємі.
Теплоємність- це кількість теплоти, яка необхідна для нагрівання тіла на один градус. Щоб нагріти тіло від температури T1 до температури Т2,потрібно затратити кількість теплоти Q:
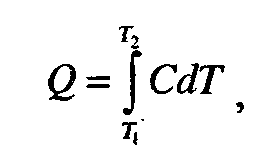
Де С – істинна теплоємність.
Звідси:

На практиці користуються питомою (Спит) і молярною (См) теплоємностями. Питома теплоємність - це теплоємність, віднесена до одного грама речовини, і дорівнює кількості теплоти, необхідної для нагрівання одного грама речовини на один градус. Молярна теплоємність - це теплоємність, віднесена до одного моля речовини, і дорівнює кількості теплоти, необхідної для нагрівання одного моля речовини на один градус. Між цими теплоємкостями існує зв'язок:
де М— молярна маса речовини.
Для ізобарних процесів використовують теплоємність при сталому тиску Ср а для ізохорних процесів - теплоємність при сталому об'ємі Cv .
Кількість теплоти, необхідна для нагрівання певної кількості речовини від температури Т1, до Т2, для ізобарних процесів розраховується за рівнянням:
Аналогічно для ізохорних процесів використовують співвідношення:
Внутрішня енергія системи
Усі тіла в природі, незалежно від агрегатного стану, мають певний запас внутрішньої енергії. Ця енергія складається з кінетичної енергії молекул та містить енергії поступального і обертового рухів, енергію руху атомів у молекулі, енергію електронів, внутрішньоядерну енергію, енергію взаємодії частинок. Кінетична енергія руху самого тіла і потенціальна енергія положення його в просторі у внутрішню енергію не входять.
Внутрішня енергія залежить тільки від параметрів стану системи, тобто є функцією стану системи. Абсолютне значення внутрішньої енергії визначити практично неможливо, але можна виміряти її зміну в хімічному процесі. Якщо система з внутрішньою енергією U1 , переходить в стан з енергією U2, то зміна внутрішньої енергії ΔU не залежить від шляху переходу, а тільки від початкового і кінцевого стану системи.
Систему можна перевести із стану 1 в стан 2 безпосередньо, або через проміжний стан Ιa:
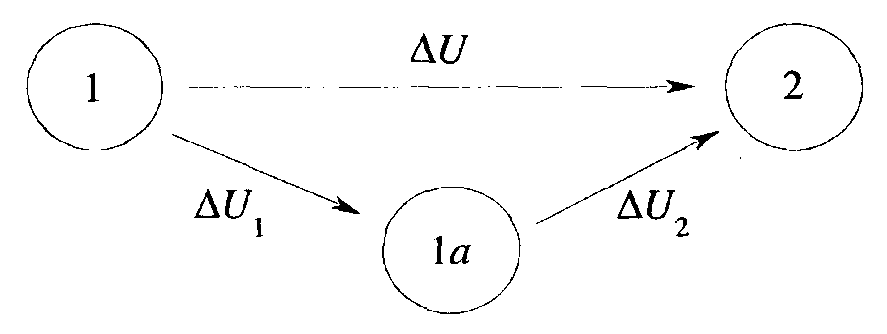
При цьому зміна внутрішньої енергії системи дорівнює:
Перший закон термодинаміки
Одним з найважливіших законів природи є закон збереження енергії, відкритий Ломоносовим та експериментально доведений Майором.
Енергія у всіх явищах природи безслідно не зникає і не з'являється, а перетворюється з однієї форми в іншу.
Всезагальним частковим випадком цього закону є перше начало термодинамік.
Зміна внутрішньої енергії системи може відбуватися тільки внаслідок притоку (відтоку) енергії з навколишнього середовища в формі теплоти або роботи.
Як приклад, розглянемо таку просту термодинамічну систему як газ, що знаходиться в циліндрі під поршнем (рис. 1). При підводі до системи теплоти Qгаз нагрівається (збільшується внутрішня енергія U) і розширюється (здійснюється робота А). Затрачена теплота Qіде на збільшення внутрішньої енергії та на виконання роботи:
де ΔU - зміна внутрішньої енергії системи;
А - механічна робота (робота розширення газу).
Це рівняння аналітично визначає перший закон термодинаміки.

Рис. 1. Зміна об'єму системи при підведенні до неї теплоти з навколишнього середовища.
Для процесів при сталому тиску робота розширення визначається рівнянням:
Звідси:
звідки·
Функція U + pVназивається ентальпією і позначається Н.
Н= U + pV
Ентальпія є функцією стану системи. Оскільки Uєфункцією стану, арі V— параметри стану, то і Η = U + pVє також функцією стану системи. Для ізобарного процесу одержимо:
З цього рівняння видно, що теплота, підведена (відведена) до системи при сталому тиску, дорівнює зміні ентальпії системи.
Якщо процес протікає при сталому об'ємі ( V2= V1), то з рівняння
одержимо:
Підведена (відведена) до системи теплота при сталому об'ємі витрачається на зміну внутрішньої енергії системи.
Різниця між ΔU і ΔΗ для газових систем досить помітна. Якщо нагрівати газ при сталому об'ємі, то вся теплота буде спрямована на збільшення внутрішньої енергії ΔU, якщо ж нагрівати газ за сталого тиску, то газ буде розширюватись і частина теплоти ΔНпіде на зміну внутрішньої енергії ΔU, а частина - на роботу розширення pΔV .
Для твердих і рідких тіл різниця між ΔU і ΔНнезначна, оскільки об'єм їх при нагріванні змінюється незначно.
Термохімія. Закон Гесса
Термохімія – розділ термодинаміки, предметом вивчення якого є теплові ефекти фізико-хімічних процесів. Знання теплових ефектів хімічних реакцій дозволяє передбачати характер перебігання хімічних процесів і керувати ними, змінюючи певним чином зовнішні умови.
При хімічних перетвореннях проходить зміна внутрішньої енергії (ентальпії) системи. Як правило, U(ΔH) речовин до реакції відрізняються від U(ΔH) речовин після реакції. Якщо внутрішня енергія продуктів реакції менша від внутрішньої енергії вихідних речовин, то енергія виділяється у вигляді тепла. Процеси, що протікають з виділенням тепла в навколишнє середовище, називаються екзотермічними, з поглинанням - ендотермічними, а без обміну енергією з навколишнім середовищем - адіабатичними. Кількість теплоти, що виділяється або поглинається при реакції, називається тепловим ефектом реакції.
Тепловим ефектом хімічної реакції називають теплоту, яка виділяється або поглинається системою в ході реакції при відсутності усіх видів роботи, крім роботи розширення, за умови рівності температури вихідних речовин і продуктів реакції, а також проведення процесу при сталості об'єму або тиску в системі.
Якщо реакція протікає при сталому об'ємі, то:
якщо за сталого тиску, то:
У термохімії користуються не хімічними, а термохімічними рівняннями, де вказується тепловий ефект і агрегатний стан речовин. Тепловий ефект реакції дорівнює зміні ентальпії реакції з протилежним знаком:
Існує два способи запису термохімічних рівнянь. Наприклад,

У сучасній термодинаміці слід читати: 1 моль водню + ½ моль кисню утворюють 1 моль води з одночасним виділенням 285,8 кДж тепла.
Основний закон термохімії — закон Гесса.
Тепловий ефект реакції залежить тільки від виду і стану вихідних речовин і кінцевих продуктів, але не залежить від проміжного стану і шляхів переходу вихідних речовин в кінцеві продукти.
При сталому тиску Qp= ΔH. При сталому об'ємі Qv= ΔU .
Якщо реакцію, що досліджується, можна представити як лінійну комбінацію інших реакцій з відомими тепловими ефектами, то закон Гесса дозволяє розраховувати невідомі теплові ефекти.
Приклад 1. Визначититепловий ефект реакції С + ½О2 = СО, якщо відомі теплові ефекти реакцій: С + О2 = СО2 , ΔH1= – 393,5 кДж/моль и СО +½О2 = СО2, ΔH2 = – 283,0 кДж/моль.
Розв’язання.
Згідно з законом Гесса: ΔH = ΔH1 – ΔH2 = – 393,5 – (– 283,0) = – 110,5 кДж/моль.
Приклад 2. Окиснення аміаку відбувається згідно з рівнянням реакції:
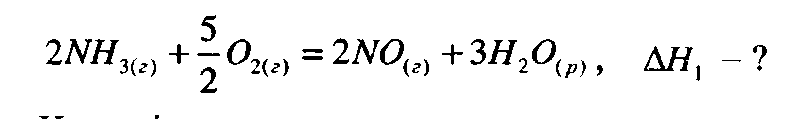
Визначити ΔH1 цієї реакції якщо відомі теплові ефекти таких процесів:
Розв’язання.
За законом Гесса: ΔH1 = ΔH2 + ΔH3= –765,15 + 180,75 = –584,4 кДж.
Теплоти утворення і згорання хімічних сполук.
Теплотою утворення сполуки називається кількість теплоти, виділеної або поглинутої при утворенні одного моля цієї сполуки з простих речовин.
Теплоти (ентальпії) утворення простих речовин (Ν2, О2, Н2та ін.) дорівнюють нулю. Як правило, теплоти утворення речовин відносять до стандартних умов (Т = 25 °С (298 К) і Р= 101325 Па ). В такому випадку говорять про стандартні теплоти (ентальпії) утворення речовин.Стандартні теплоти утворення позначаються
 або
або  ( індекс f–formationпозначає утворення). За теплотами утворення речовин можна розрахувати тепловий ефект будь-якої реакції.
( індекс f–formationпозначає утворення). За теплотами утворення речовин можна розрахувати тепловий ефект будь-якої реакції.Перший наслідок з закону Гесса:
тепловий ефект реакції дорівнює різниці між теплотами утворення продуктів реакції і теплотами утворення вихідних речовин:
Приклад 3. Розрахувати тепловий ефект реакції
за стандартних умов.
Розв’язання.
Стандартні ентальпії утворення речовин (
 або
або  , де індекс f позначує –formation (утворення)):
, де індекс f позначує –formation (утворення)):Тоді тепловий ефект реакції (
 або
або 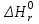 ):
):ΔН 298 (р-ції) = -3439,3 - (-1674,0 - 3 · 395,4) = -579,1 кДж/моль.
Інколи вигідно вираховувати тепловий ефект реакції за теплотами згорання. Теплота згорання - це теплота, що виділяється при повному згоранні 1 моля речовини в кисні.
Теплові ефекти розчинення речовин
Тепловий ефект при розчиненні твердих тіл
 визначається співвідношенням енергії, що витрачається на руйнування кристалічної ґратки речовини
визначається співвідношенням енергії, що витрачається на руйнування кристалічної ґратки речовини  , та енергії, що виділяється при взаємодії молекул та іонів з розчинником
, та енергії, що виділяється при взаємодії молекул та іонів з розчинником  :
:
Якщо енергія кристалічної ґратки більша за енергію сольватації, то речовина розчиняється з поглинанням тепла. В протилежному випадку при розчиненні теплота виділяється.
Оскільки тепловий ефект при розчиненні залежить від концентрації розчину, то при термохімічному дослідженні розчинів використовують декілька величин, що описують процес розчинення. Інтегральною теплотою розчинення називають зміну ентальпії системи, що відбувається при розчиненні 1 моль речовини в деякій кількості розчинника з утворенням розчину з моляльністю
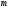 . Часто цю величину називають просто теплотою розчинення. Особливий інтерес представляє перша інтегральна теплота розчинення
. Часто цю величину називають просто теплотою розчинення. Особливий інтерес представляє перша інтегральна теплота розчинення  – зміна ентальпії при розчиненні 1 моль речовини з утворенням нескінченно розведеного розчину – і повна інтегральна теплота розчинення – зміна ентальпії при розчиненні 1 моль речовини з утворенням насиченого розчину. Тепловий ефект розчинення 1 моль речовини в нескінченно великій кількості розчину називають диференціальною теплотою розчинення. Очевидно, що диференціальна теплота розчинення в чистому розчиннику збігається з першою інтегральною теплотою розчинення. Експериментальному визначенню легко піддаються лише інтегральні (крім першої), проміжні теплоти розчинення
– зміна ентальпії при розчиненні 1 моль речовини з утворенням нескінченно розведеного розчину – і повна інтегральна теплота розчинення – зміна ентальпії при розчиненні 1 моль речовини з утворенням насиченого розчину. Тепловий ефект розчинення 1 моль речовини в нескінченно великій кількості розчину називають диференціальною теплотою розчинення. Очевидно, що диференціальна теплота розчинення в чистому розчиннику збігається з першою інтегральною теплотою розчинення. Експериментальному визначенню легко піддаються лише інтегральні (крім першої), проміжні теплоти розчинення  – зміна ентальпії при розчиненні 1 моль речовини в розчині з концентрацією
– зміна ентальпії при розчиненні 1 моль речовини в розчині з концентрацією  з утворенням розчину з моляльністю
з утворенням розчину з моляльністю  , а також теплоти розведення розчину від
, а також теплоти розведення розчину від  до
до  , що відбувається при додаванні розчинника до розчину. Першу та повну інтегральні, а також диференціальні теплоти розчинення знаходять шляхом відповідної обробки експериментальних даних.
, що відбувається при додаванні розчинника до розчину. Першу та повну інтегральні, а також диференціальні теплоти розчинення знаходять шляхом відповідної обробки експериментальних даних.Експериментальне визначення теплових ефектів проводять у калориметрах, які являють собою термічно ізольовану від навколишнього середовища судину. Кількість теплоти, що виділяється або поглинається в ході процесу, що досліджується, визначається за зміною температури в калориметрі. Точне вимірювання температури здійснюється за допомогою термометра Бекмана, термопар, термісторів та інших високоточних пристроїв. Для розрахунку теплового ефекту процесу, що відбувається у калориметрі, необхідне знання константи калориметра – величини, яка чисельно дорівнює кількості теплоти, що необхідна для нагрівання калориметра з реагентами на один градус. За своїм фізичним змістом константа калориметра дорівнює його питомій теплоємності. Константу калориметра визначають, проводячи в калориметрі реакцію з відомим тепловим ефектом, наприклад, реакцію нейтралізації або реакцію згоряння бензойної кислоти. Більш високої точності досягають, використовуючи електричний нагрівач, який поміщають в калориметр та підводять відому кількість електрики. Константу калориметра в цьому випадку знаходять як відношення кількості теплоти, що була отримана калориметром, до зміни температури, що відбувається внаслідок роботи нагрівача
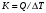 .
.Кількість теплоти, що виділяється при роботі нагрівача, розраховують за законом Джоуля–Ленца,

де
 – напруга,
– напруга, 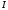 – сила току,
– сила току, 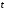 – час роботи нагрівача.
– час роботи нагрівача. Зміну температури, що відбувається під час процесу, який досліджується, розраховують, виходячи із залежності температура – час, яку отримують під час проведення експерименту. Для знаходження точного значення
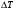 використовують спеціальні методики, що враховують теплообмін калориметра з оточуючим середовищем. Найбільш проста з них полягає у наступному.
використовують спеціальні методики, що враховують теплообмін калориметра з оточуючим середовищем. Найбільш проста з них полягає у наступному.1. Будують графік залежності температури у калориметрі від часу. Приклад такого графіка для ендотермічного процесу наведений на рис. 1. На цій залежності виділяють три періоди: початковий (інтервал часу від
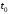 до
до  ), головний (від (від
), головний (від (від  до
до 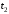 ) та заключний (від
) та заключний (від 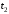 до
до  ). Під час початкового та заключного періодів температура змінюється виключно за рахунок теплообміну калориметра з середовищем, під час головного – за рахунок процесу, що досліджується.
). Під час початкового та заключного періодів температура змінюється виключно за рахунок теплообміну калориметра з середовищем, під час головного – за рахунок процесу, що досліджується. 2. Виконують додаткові креслення – будують прямі лінії АА' та СС', що є продовженням початкового та заключного періодів. Знаходять на вісі ординат точки
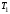 та
та  , які відповідають початку та кінцю головного періоду, відмічають середину відрізку
, які відповідають початку та кінцю головного періоду, відмічають середину відрізку 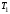
 та проводять через цю точку пряму, що паралельна вісі абсцис, до перетину її з кривою температура – час. Через знайдену таким чином точку Е проводять вертикальну лінію до перетину її з лініями АА' та СС'.
та проводять через цю точку пряму, що паралельна вісі абсцис, до перетину її з кривою температура – час. Через знайдену таким чином точку Е проводять вертикальну лінію до перетину її з лініями АА' та СС'. 3. Довжина відрізку BD відповідає істинній зміні температури, що відбувається внаслідок перебігання процесу, який досліджується.

Рис. 1. Графічне знаходження істинної зміни температури під час перебігу фізико-хімічного процесу
Залежність теплового ефекти реакції від температури
Залежність теплового ефекти реакції від температури дає рівняння Кірхгофа:
 ,
,де ср – молярна теплоємність, Δср=Σ(νі∙ср,і)прод– Σ(νі∙ср,і)вих..
Теплоємності речовин визначаються експериментально або розраховуються теоретично. Залежності теплоємності від температури звичайно представляють у вигляді інтерполяціонних рівнянь:

або


Приклад 5.
Визначити тепловий ефект реакції 2СН4 + СО2 = СН3СОСН3(г) +Н2О(г) при Т=500 К.
Розв’язання.
Для розрахунків
 використаємо рівняння Кірхгофа в такій формі
використаємо рівняння Кірхгофа в такій формі 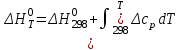 .
.Проінтегруємо це рівняння в межах від 298 до Т:

Розрахунки
 и
и 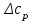 проводимо з використанням довідкових даних [Понамарёва А.М., Равдель А.А Краткий справочник физико-химических величин. Л., 2003]. Ці дані занесемо у таблицю.
проводимо з використанням довідкових даних [Понамарёва А.М., Равдель А.А Краткий справочник физико-химических величин. Л., 2003]. Ці дані занесемо у таблицю.| Речовина |  | а·103 | b·106 | c'·10-2 | c·109 |
| кДж/(моль·К) | |||||
| Н2О (г) | –242,00 | 30,15 | 11,31 | – | – |
| СН3СОСН3 (г) | –216,80 | 22,49 | 201,93 | – | –63,58 |
| СО2 | –393,80 | 44,17 | 9,04 | –8,54 | – |
| СН4 | –74,90 | 17,48 | 60,50 | – | –1,12 |
 розрахуємо за першім наслідком з закону Гесса
розрахуємо за першім наслідком з закону Гесса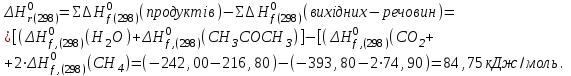


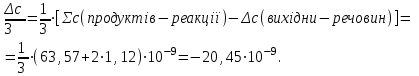
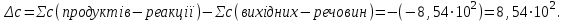
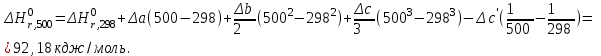
Другій закон термодинаміки
Усі процеси, що протікають в природі самовільно, мають певний напрям. Тепло переходить від більш нагрітого тіла до менш нагрітого, рідина тече зверху вниз, газ переходить із середовища з більшим тиском в середовище з меншим тиском (відбувається вирівнювання концентрацій за рахунок дифузії). Першого закону термодинаміки недостатньо для визначення напрямку процесу. Для цього був уведений другий законтермодинаміки.
Є декілька формулювань цього закону. Найбільш прийнятний постулат Клаузіуса:
"Теплота самочинно не може переходити від холодного тіла до більш нагрітого".
Подібно сформулював другий закон і Ломоносов. Дійсно, тепло від більш нагрітого тіла буде переходити до менш нагрітого, поки не настане рівновага. Стан рівноваги досить поширений у природі. Будь-який самочиний процес врешті призводить до стану рівноваги.
Процеси, яки відбуваються в системи без втручання ззовні називаються самочинними. В іншому випадку процеси відносять до несамочинних.
Розрізняють також рівноважні і нерівноважні процеси. При рівноважному процесі система безперервно проходить послідовний ряд станів, нескінченно близьких до рівноважних. Система в який відбувся рівноважний процес може повернутися у вихідний стан, пройшовши у зворотному напрямку ті ж рівноважні стадії, що і прямому процесі. Ця властивість рівноважного процесу називається його оборотністю.
Другий закон термодинаміки носить статистичний характер. Він строго виконується тільки для макросистем. В рамках класичної термодинаміки другий закон термодинаміки має характер постулату. Повне фізичне пояснення другого закону термодинаміки дає статистична термодинаміка.
Класичне введення ентропії.
В класичної термодинаміки для з’ясування питання про напрямок протікання самочинних процесів введена термодинамічна функція ентропія (S):

Зміна ентропії при в різних процесах
Зміна ентропії при фазових переходах (плавлення, випаровування, сублімація) визначається зарівнянням:

Де Qф.п. - мольна теплота фазового переходу;
Τ - температура фазового переходу. Ентропія зростаєпри переході системи з твердого стану в рідкий, і з рідкого - в газоподібний:
Ентропія зростаєтакож при нагріванні речовини від температури Т1, до Т2:

де С - теплоємність речовини.
При нагріванні речовини при сталому об'ємі або тиску зміна ентропіїрозраховується за рівняннями:


При ізотермічному розширенні моля газу:

При змішуванні двох ідеальних газів при сталих тиску і температурі:

Приклад 6.
Визначитизміну ентропії під час переходу 2,7 кг води при р1=1,013·105 Па і Т1=293 К у пару при р2=0,5067·105 Па і Т2=373 К. Прийняти, що Ср≈Сv=4,187·103 Дж/(кг·К), а питома теплота випарування води дорівнює 2260,9·103 Дж/кг.
Розв’язання.
Зміна ентропії не залежить від шляху процесу. Розіб’ємо процес на окремі стадії в яких такі ж самі кінцевий і початкові стани системи.
Стадія 1 – підігрів води при р1=1,013·105 Па от Т1=293 К до Т2=373 К.
Стадія 2 – перетворення води у пару при р1=1,013·105 Па і Т2=373 К.
Стадія 3 – ізотермічне розширення водяної пари при Т2=373 К від р1=1,013·105 Па до р2=0,5067·105 Па.

Значення ентропій речовин за стандартних умов (S°) наведені у довідниках. Ентропія використовується для визначення можливості протікання самочинного процесу в ізольованій системі:
В ізольованій системі самочинно можуть відбуватися процеси тільки зі зростанням ентропії (ΔS>0). При досягненні системою максимального значення ентропії система переходе в стан хімічної рівноваги.
Приклад 7.
Визначити можливість протікання процесу С2Н2 + 2Н2О(ж) = СН3СООН(ж) + Н2 в ізольованій системі за стандартних умов.
Розв’язання.
Умовою можливості відбування самочинного процесу в ізольованій системі є виконання нерівності ΔS>0.Для розв’язання задачі використаємо значення стандартних абсолютних ентропій речовин, що наведені в довідниках.

ΔS<0 – самочинний процес неможливий.
Енергія Гіббса и енергія Гельмгольца
За допомогою термодинамічної функції ентропії можна відповісти на питання о можливості відбування самочинного процесу в ізольованій системі. В замкненій системі для відповіді на питання про можливість самочинного протікання процессу використовують дві термодинамічні функції – енергію Гіббса (G) і енергію Гельмгольца (F).

Енергія Гіббса використовується для визначенні можливості самочинного протікання процесу за сталих Р і Т, тому її інколи називають ізобарно-ізотермічним потенціалом. Енергія Гельмгольца використовується для визначенні можливості самочинного протікання процесу за сталих V і Т, тому її інколи називають ізохорно-ізотермічним потенціалом.
Умовою самочинного протікання процесу при сталому тиску і температурі буде нерівність ΔG < 0. Тобто, в системах зі сталими тиском та температурою самочинно протікають пронеси, що супроводжуються зменшенням енергії Гіббса..
Умовою самочинного протікання процесу при сталому об'ємі і температурі буде нерівність ΔF < 0. Тобто, в системах зі сталими об'ємом та температурою самовільно протікають процеси, що супроводжуються зменшенням ізохорно-ізотермічного потенціалу.
Висновки щодо самовільного протікання процесів при ΔG < 0 і ΔF< 0 є основним формулюванням другого закону термодинаміки стосовно хімічних процесів. Якщо значення ΔG і ΔF позитивні, то процес не протікає. В умовах рівноваги ΔG = 0 і ΔF = 0 , a G і F мають мінімальні значення.
Розрахунок зміни термодинамічних потенціалів у хімічних реакціях
Для визначення ΔG хімічної реакції можна використати рівняння, аналогічне з розрахунком ΔН :
Значення енергій Гіббса утворення речовин за стандартних умов (
 ) наведені у довідниках.
) наведені у довідниках.Приклад 8.
Визначити можливість протікання реакції:
За стандартних умов при сталому тиску.
Розв’язання.
Розрахуємо ΔG0298 для реакції і визначимо можливість її протікання. Стандартні ізобарні потенціали утворення речовин реакції становлять:
Тоді:

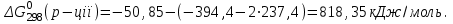
Одержано позитивне значення ΔG, тобто при даній температурі цей самочинне відбування процесу не можливе.