
Ім'я файлу: Реф6.docx
Розширення: docx
Розмір: 244кб.
Дата: 25.07.2021
скачати
Пов'язані файли:
БЖД.docx
Реферат.pdf
Лаб. 5.docx
Розширення: docx
Розмір: 244кб.
Дата: 25.07.2021
скачати
Пов'язані файли:
БЖД.docx
Реферат.pdf
Лаб. 5.docx
Задача №1
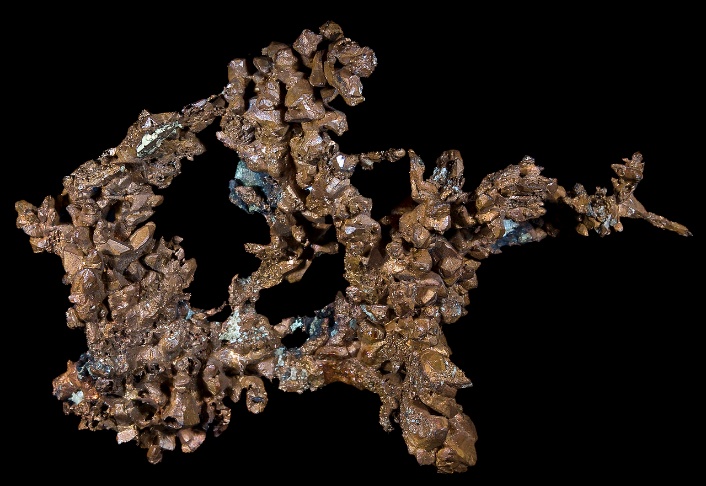 Мідь
МідьВизначення: Мідь—хімічний елемент з атомним номером 29, що належить до 11-ї групи, 4-го періоду періодичної системи хімічних елементів.
Класифікація: Специфічні особливості міді, що властиві різним маркам, визначаються не вмістом міді (відмінності складають не більше 0,5 %), а вмістом конкретних домішок (їх кількість може відрізнятися у 10–50 разів). Часто використовують класифікацію марок міді за вмістом кисню:
безкиснева мідь: М00б, М0б з вмістом кисню до 0,001 % і М1б до 0,003 %;
рафінована мідь (М1ф, М1р, М2р, М3р) з вмістом кисню до 0,01 %, але з підвищеним вмістом фосфору;
мідь високої чистоти (М00, М0, М1) з вмістом кисню 0,03–0,05 %;
мідь загального призначення (М2, М3) з вмістом кисню до 0,08 %.
Основні параметри: Густина 8,940 r/см3. tпл 1084,5°С; tкип 2540 °С. Твердість за Моосом — 2,5-3. Хімічно малоактивна, але на повітрі завжди вкрита шаром оксидів або основного карбонату. Домішки: Ag, As, Fe, Bi, Sb, Hg, Ge. Взаємодіє з галогенами, сіркою, селеном, утворює комплексні сполуки з ціанідами і ін. Солі одновалентної міді у воді або нерозчинні, або якщо не стабілізуються комплексотворенням диспропорціонують. Стабілізовані комплексотворенням сполуки одновалентної міді ([Cu(NH3)2]+, [Cu(Г)2]- де Г — галоген (крім F) або ціанід-іон) легко окиснюється до сполук двовалентної міді, що використовується для очищення газів від кисню: їх пропускають через водний розчин амоніаку з порошком міді, при цьому поверхневий шар оксиду розчиняється і мідь вільно окиснюється. На практиці поведінку амоніачних розчинів оксидів міді можна спостерігати поклавши круглу мідну пластинку (монету) у прозору посудину з водним розчином амоніаку так, щоб розділити розчин на дві частини. У верхній частині, завдяки доступу кисню, розчин забарвиться в темно-синій колір сполуками двовалентної міді, в нижній сполуки двовалентної міді прореагують з металевою міддю з утворенням безбарвних сполук одновалентної міді, тому розчин буде світлішим або безбарвним. Солі двовалентної міді добре розчинні у воді і в розбавлених розчинах повністю дисоційовані. Кларк міді 4,7·10−3 % за масою. В основних гірських породах її середній вміст трохи вищий (10−2). Мідь характерна для основного і кислого магматизму. При першому вона концентрується в магматичних і скарнових родовищах і поствулканічних колчеданних рудах. У зв’язку з гранітним магматизмом формуються мідно-порфірові і жильні родовища.
Числові значення параметрів:
| Густина | 8,96 г/см³ |
| Молярна теплоємність | 0,385 Дж/(К·моль) |
| Теплопровідність | 401 Вт/(м·К) |
| Температура плавлення | 1356,6 К |
| Теплота плавлення | 13,01 кДж/моль |
| Температура кипіння | 2840 К |
| Теплота випаровування | 304,6 кДж/моль |
| Молярний об'єм | 7,1 см³/моль |
Характеристика та властивості: Відомо 170—200 мінералів міді, але промислове значення мають близько 20. До них належать:
самородна мідь Cu (92 %),
халькопірит (мідний колчедан) CuFeS2 (34,6 %),
борніт Cu5FeS4(63,3 %),
кубаніт CuFe2S3 (22–24 %),
халькозин Cu2S (79,9 %),
ковелін (мідний блиск) CuS (66,5 %),
тенантит 3Cu2S·As2S3 (57,5 %),
тетраедрит 3Cu2S·Sb2S3 (52,3 %),
енаргіт Cu3AsS4,
куприт Cu2O (88,8 %),
тенорит CuO (79,9 %),
малахіт Cu2CO3·Cu(OH)2 (57,4 %),
азурит 2 CuCO3·Cu(OH)2 (55,3 %),
халькантит Cu[SO4]•5H2O (31,8 %),
брошантит CuSO4·3Cu(OH)2 (56,2 %),
атакаміт CuCl2·3Cu(OH)2 (59,5 %),
хризокола CuSiO3·nH2O (36,6),
делафосит CuFeO2, ендрюсит та ін.
Сульфіди міді (халькопірит, халькозин, борніт, лаутит) є найголовнішими в її рудах; підлегле значення мають сульфосолі (бляклі руди) і сульфоарсеніди (енаргіт); ще менше — оксиди, карбонати і силікати (див. мідні руди).
Порівняно з алюмінієм мідь характеризується кращими електро- й теплопровідністю, доброю тривкістю до корозії на повітрі, у прісній та морській воді, а також у багатьох хімічних середовищах, її легко обробляти тиском, паяти і зварювати, проте вона має невисокі ливарні властивості й погану оброблюваність різанням. За електро- й теплопровідністю мідь посідає друге місце після срібла. З огляду на низьку межу плинності й порівняно високу вартість мідь у конструкціях майже не застосовується.
Механічні й технологічні властивості міді помітно знижують шкідливі домішки — вісмут, свинець, сірка й кисень. Вісмут і свинець практично не розчиняються в міді й утворюють з нею легкоплавкі евтектики, які, розміщуючись на границях зерен, призводять до руйнування міді під час її гарячої обробки тиском. Тому масова частка вісмуту в міді не повинна перевищувати 0,002 %, а свинцю — 0,005 %. У свою чергу, сірка й кисень погіршують пластичність міді, утворюючи на границях зерен крихкі евтектики.
Найпоширенішими сплавами міді є латуні та бронзи. Легують мідь цинком, оловом, алюмінієм, кремнієм, марганцем, нікелем, берилієм тощо. Ці елементи підвищують твердість і міцність мідних сплавів, практично не знижуючи їх пластичність, а окремі з них (Zn, Sn, Аl) навіть підвищують її. Алюміній, марганець і олово поліпшують корозійну стійкість, окрім цього олово, кремній і марганець у певних концентраціях підвищують антифрикційні властивості сплавів міді. Залізо сприяє подрібненню зерна, а кремній підвищує ливарні властивості сплавів. Пластичність багатьох однофазових мідних сплавів є дуже високою, а міцність у рівноважному стані (γв = 250—550 МПа) нижча порівняно зі сталями. Винятком щодо міцності може бути берилієва бронза, зміцнена термообробкою.
За технологічною ознакою розрізняють деформівні та ливарні сплави міді.
Манганин
Визначення: Манганин — термостабільний сплав на основі міді з додаванням марганцю та нікелю.
Класифікація: Існує кілька різновидів манганина, наприклад, такі:
| Масовий вміст компонентів,% | Макс. робоча температура, °C | Питомий опір, 10-8 Ом · м | ТКС, 10-5 К -1 |
| 86 Cu, 12 Mn, 2 Ni | 300 | 43 | 1 ÷ 2 |
| 85 Cu, 2 Mn | 300 | 51 | 0,8 |
| 84 Cu, 13 Mn, 2 Al | 400 | 50 | -0,2 ÷ -2 |
| 85 Cu, 9,5 Mn, 5,5 Al | 400 | 45 | 1 ÷ 3 |
 Також існують так звані «срібні Манганін», - сплави з поліпшеними електричними властивостями на основі срібла замість міді, з додаванням марганцю (до 17%), олова (до 7%) та інших хімічних елементі
Також існують так звані «срібні Манганін», - сплави з поліпшеними електричними властивостями на основі срібла замість міді, з додаванням марганцю (до 17%), олова (до 7%) та інших хімічних елементіОсновні параметри: залежність від температури електричного опору манганина вкрай незначна, а це фактор на користь сталості опору, що дуже значим о для прецизійних електровимірювальних пристроїв. Мала термо-ерс - ще одна перевага манганина, і при зіткненні з мідними елементами вона не перевищить 0,000001 вольта на градус.
З метою стабілізації електричних характеристик дроту з манганина її нагрівають в умовах вакууму до 400 ° С, і витримують при такій температурі протягом від 1 до 2 годин. Потім дріт тривало витримують при кімнатній температурі для досягнення прийнятної однорідності сплаву і для отримання стабільних властивостей.
У звичайних робочих умовах така дріт зможе бути використана при температурах до 200 ° С - для стабілізованого манганина, і до 60 ° С - для нестабілізованої манганина, бо нестабілізований манганин при нагріванні від 60 ° С і вище зазнає незворотні зміни, які позначаться на його властивості . Так, нестабілізований манганин краще не нагрівати до 60 ° С, і слід вважати цю температуру максимально допустимої.
На сьогоднішній день промисловістю випускається як гола манганіновим дріт, так і дріт в високоміцної емалевої ізоляції - для виготовлення обмоток, в шовковій ізоляції, і в двошарової лавсанової ізоляції.
Числові значення параметрів: Манганіновим дріт діаметром від 0,02 до 6 мм (або стрічка товщиною від 0,09 мм) буває твердою або м'якою. Відпалений м'яка дріт має міцність на розрив від 45 до 50 кг /кв. мм, відносне подовження становить від 10 до 20%, питомий опір - від 0,42 до 0,52 Ом*кв. мм/м.
Характеристики твердого дроту: міцність на розрив від 50 до 60 кг / кв.мм, відносне подовження - від 5 до 9%, питомий опір - 0,43 - 0,53 Ом * кв.мм / м. Температурний коефіцієнт дротів або стрічок з манганина лежить в межах від 3 * 10-5 до 5 * 10-5
1 /°С, а для стабілізованих - до 1,5 *10-5 1/°С.
Характеристика та властивості:
| Фізичні властивості | |
| густина | 8,4⋅10 3 кг / м³ |
| міцність | 300-600 МПа |
| Температура плавлення | 960 ° C |
| корозійна стійкість | середня |
| Питомий електричний опір | 0,43-0,48⋅10 -6 Ом · м. |
| Коефіцієнт лінійного розширення | 14-19⋅10 -6 1 / К |
| теплопровідність | 22 Вт / (м · К) |
| Подовження при розриві | <50% |
| модуль Юнга | 124-159 МПа |
Широко застосовується в вимірювальної техніки для виготовлення додаткових резисторів і шунтів (в складі приладів або вигляді самостійних виробів). З манганина виготовляють міри електричного опору - наприклад, магазини опорів .
Суттєва перевага манганина в цих цілях перед константаном - манганин володіє дуже малою термо-ерс в парі з міддю (не більше 1 мкВ / К), тому в приладах високого класу точності, або приладах, призначених для вимірювання дуже малих напруг застосовують тільки манганин. У той же час манганин, на відміну від константана, нестійкий проти корозії в атмосфері, що містить пари кислот, аміаку, а також чутливий до зміни вологості повітря. Практично нульове значення ТКС манганин зберігає до температур 70-80°C. Для зниження ТКС і зниження зміни питомої електричного опору в часі манганіновим дріт піддають відпалу при температурах 550-600°C у вакуумі з подальшим повільним охолодженням. Такий дріт може зберігати свої електричні властивості при температурах до 200°C . Виготовлені резистори іноді додатково випалюються при температурі 200°C.
Задача 2
Арсенід галію
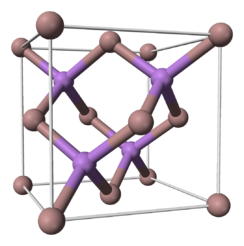 Визначення: Арсенід галію — кристалічна речовина із кристалічною ґраткою типу цинкова обманка.
Визначення: Арсенід галію — кристалічна речовина із кристалічною ґраткою типу цинкова обманка.Класифікація: Належить до класу інтерметалічних сполук елементів ІІІ і V груп періодичної системи елементів, скорочено — сполуки AIIIBV. Арсенід галі ю має кубічну гранецентровану ґратку типу ґратки цинкової обманки.
Залежність факторів електропровідності: Прямозонний напівпровідник із шириною забороненої зони 1,424 еВ. Широко використовується для створення напівпровідникових пристроїв, багатошарових структур, квантових точок, дротин й ям.
Характеристика та властивості: Арсенід галію отримують, сплавляючи чисті арсен (As) і галій (Ga) у кварцовій колбі при температурі близько 1240° C при тиску пари близько 1000 ГПа. Кристали ростуть із зародків, що утворюються самовільно.
| Молекулярна формула | Ga(As) |
| Молярна маса | 144.645 г/моль |
| Молекулярна маса | 143.847177329 г/моль |
| Зовнішній вигляд | Дуже темно-червоні, скловидні кристали |
| Запах | часнику при зволоженні |
| Густина | 5.3176 г/см3 |
| Тпл | 1238 |
| Розчинність (вода) | нерозчинний |
| Розчинність | розчинний в хлоридній кислоті, етанолі, метанолі, ацетоні |
| Показник заломлення (nD) | 3,8 |
Тип провідності й рухливість носіїв заряду в кристалах залежить від концентрації домішок, що залишаються при виготовлені. Найважливішими з них є кремній та мідь, які переходять в арсенід галію з кварцу (кремній) і тигелів чи ампул (мідь). Кремній є, тому здебільшого отримані кристали мають n-тип провідності.
Призначення та принцип дії: Арсенід галію використовується в сонячних елементах з 1970-х років, оскільки він має видатні фотоелектричні характеристики, що дає йому перевагу перед іншими матеріалами.
Він працює краще, ніж кремній, при перетворенні сонячної енергії в електроенергію, забезпечуючи більше енергії при сильному нагріванні або в умовах слабкого освітлення, що є двома загальними умовами, які переносять сонячні елементи, коли змінюються освітлення та рівень температури.
Деякі з цих сонячних елементів використовуються в автомобілях на сонячних батареях, космічних апаратах та супутниках. Він стійкий до вологи та ультрафіолетового випромінювання, що робить його більш міцним проти умов навколишнього середовища та дозволяє використовувати в аерокосмічній галузі.
Він має низький температурний коефіцієнт, тому не втрачає ефективності при високих температурах і протистоїть високим накопиченим дозам радіації. Радіаційні пошкодження можна усунути загартуванням лише при 200°C.
Він має високий коефіцієнт поглинання фотонів світла, тому має високі показники при слабкому освітленні, тобто втрачає дуже мало енергії при поганому освітленні від сонця. Він виробляє більше енергії на одиницю площі, ніж будь-яка інша технологія. Це важливо, коли у вас є невелика територія, така як літаки, транспортні засоби або невеликі супутники.
Це гнучкий та низько важкий матеріал, який є ефективним навіть у дуже тонких шарах, що робить сонячний елемент дуже легким, гнучким та ефективним.
Властивості цієї сполуки спонукали її використовувати для генерування випромінювання з частотами терагерц, що є випромінюванням, яке може проникати в усі типи матеріалів, крім металів та води.
Терагерцове випромінювання, оскільки воно є неіонізуючим, може застосовуватися для отримання медичних зображень, оскільки воно не пошкоджує тканини тіла і не викликає змін в ДНК, як рентгенівські промені.
Ці випромінювання також дозволять виявляти приховану зброю в людях та багажі, можуть бути використані в методах спектроскопічного аналізу в хімії та біохімії та можуть допомогти виявити приховані витвори мистецтва у дуже старих будівлях.
Було показано, що один із типів лазерів GaAs корисний для посилення регенерації м’язової маси, пошкодженої типом зміїної отрути у мишей. Однак необхідні дослідження для визначення його ефективності у людей.
Застосовується як напівпровідник у магнітоопірних пристроях, термісторах, конденсаторах, фотоелектронній волоконно-оптичній передачі даних, мікрохвилях, інтегральних мікросхемах, що використовуються в пристроях для супутникового зв'язку, радіолокаційних системах, смартфонах (технологія 4G) та планшетах.
Ця система дозволяє визначити положення об’єкта чи людини на всій планеті з точністю до сантиметрів.
Силітові стрижні
Визначення: Стрижень — частина ливарної форми, яка служить для утворення порожнини у відливку.
Класифікація:
I клас - стрижні складної форми з дуже тонкими перетинами і малими знаками, з яких утруднений вихід газів. Такі стрижні більшою площею стикаються з металом.
II клас - стрижні, в яких масивні виступаючі частини поєднуються з тонкими виступами, ребрами, перемичками і стикаються на більшій площі з розплавленим металом. Такі стрижні утворюють в відливання повністю або частково необроблювані поверхні. У порівнянні зі стрижнями I класу вони мають розвиненіші знаки.
III клас - стрижні середньої складності, які не мають особливо тонких перетинів, а також центрові стрижні нескладної форми, що утворюють в відливання відповідальні необроблювані порожнини.
IV клас - стрижні, що мають нескладну форму і утворюють в відливання внутрішні і зовнішні оброблювані порожнини середньої і малої складності.
V клас - масивні стрижні, що утворюють в відливання великі порожнини.
Характеристика та властивості: Значна кількість форм і майже всі стрижні піддаються сушінню для збільшення газопроникності й міцності. При цьому з форм і стрижнів видаляється волога, частково або повністю вигорають органічні домішки, окисляються різні зв’язувальні речовини.
Температура й тривалість сушіння залежить від розміру форм і стрижнів, маси й хім. сполуки матеріалів.
Оптимальна температура для сушіння форм для чавунного й кольорового лиття – 350…400ºС, для сталевого – 400…450ºС.
Стрижні в яких в якості закріплювачів застосовані декстрин і сульфітна барда, сушать при 160…180ºС, стрижні на маслі – при 200…220ºС, на глині – при 300…350ºС.
Сушильні печі для форм і стрижнів можуть бути безперервної дії, стаціонарні й переносні. У цей час застосовують сушіння інфрачервоними променями.
Прогресивним способом є виготовлення стрижнів і ливарних форм зі швидковисихаючих сумішей на рідкому склі. Сушіння або хімічне твердіння їх досягається продувкою вуглекислим газом.
Призначення та принцип дії: Модель установлюють на підмодельну дошку й припудрюють пилом. Потім через сито її покривають лицювальною формувальною сумішшю шаром 20...30 см. Цей шар ущільнюють, після чого в опоку засипають наповнювальну формувальну суміш і втрамбовують її до певної щільності за допомогою ручного або пневматичного трамбування. Надлишок суміші видаляють лінійкою, а формувальну суміш у нижній пів формі наколюють для утворення вентиляційних каналів для відводу газів. Цим закінчується підготовка нижньої пів форми. Потім вона перевертається й зверху ставиться верхня опока. Її фіксують штирями, які вставляють в отвори припливів, припорошують дрібним розділювальним піском і загладжують поверхню нижньої пів форми. Для утворення ливника й випору у верхню частину форми встановлюють окремі моделі. Верхню опоку наповнюють лицювальною й наповнювальною формувальною сумішшю так само, як і нижню. Коли набивання верхньої опоки закінчено, знімають верхню пів форму, прорізають у нижній опоці ливниковий канал, загладжують порожнини рознімання форми, обережно за допомогою гачка витягають із нижньої пів форми модель, потім установлюють верхню опоку, з якої також вилучені моделі, і скріплюють обидві опоки.
Матеріали, що використовуються у даному приладі:
При виготовленні стрижнів застосовуються технологічне оснащення (стрижневі ящики, шаблони), інструмент, каркаси-рамки, пристосування для освіти вентиляційних каналів, сушильні плити і ін. Стрижні виготовляють за стрижневими ящиками та шаблонами. Залежно від способу виробництва стрижнів розрізняють ящики для ручного та машинного формування. Поодинокі великі стрижні можуть виконуватися по шаблонах з горизонтальною і вертикальною віссю обертання і протяжним. При одиничному і дрібносерійного виробництва застосовують дерев'яні, а при серійному і масовому - металеві ящики. Їх конструкція залежить від конфігурації стрижня, характеру виробництва і способу виготовлення (ручний, на пневматичних струшуючих, піскодувних, пескострельних і пескометной машинах).
Інструмент. При виконанні стрижнів, головним чином вручну, застосовують ті ж інструменти, що і при виготовленні форм: трамбування ручні та пневматичні (нормальні і укорочені), гладилки, ложечки, ланцети, гачки, вентиляційні голки і рамки, кисті і пульверизатори і т. п. Зміцнення стрижнів в сирому і сухому станах досягається армуванням їх дротяними і литими каркасами. Дрібні циліндричні і призматичні стержні армуються каркасом з обпаленого м'якого дроту, а більш складні - каркасом, вигнутим з дроту за обрисами стержня. Литі каркаси застосовують для середніх і великих стрижнів. Конструкція каркаса повинна забезпечувати їх вільне витяг з виливків для повторного використання. Цій вимозі відповідають литі каркаси з окремих нормалізованих елементів.
Процес виготовлення стрижнів на пескострельних машинах має ряд переваг: можливість застосування як металевих, так і дерев'яних ящиків; зменшення їх зносу; скорочення витрат стисненого повітря; можливість використання стрижневих сумішей з підвищеними характеристиками міцності властивостями і в'язкістю.
Процес піскодувні ущільнення суміші в ящику протікає з великою швидкістю, що забезпечує високу продуктивність машини.
Задача 3
Залізо чисте (карбонільне)
Визначення: Залізо — хімічний елемент з атомним номером 26, що належить до 8-ї групи, 4-го періоду періодичної системи хімічних елементів.
Класифікація: Залізо — поширений елемент метеоритної речовини: в кам'яних метеоритах міститься до 25 %, а в залізних 90,85 мас.% Fe. Космічна поширеність заліза близька до його вмісту в фотосфері Сонця — 627 г/т. Частка заліза в речовині Землі досить велика — 38,8 %. Найбідніша на залізо — поверхня Землі.
Найважливішими природними сполуками заліза, що мають промислове значення, є магнітний залізняк Fe3O4, червоний залізняк Fe2O3, бурий залізняк Fe2O3 · nH2O та пірит FeS2. Оксиди заліза служать рудами, з яких добувають залізо, а сульфіди — сировиною для сульфатно-кислотного виробництва.
Поширеність заліза в гірських породах (% за масою): ультраосновні — 9,85; основні — 8,56; середні — 5,85; кислі — 2,70; лужні — 3,60; осадові — 3,33. Відомо понад 300 мінералів.
Найважливіші мінерали заліза: гематит Fe2O3 (70 % Fe), магнетит Fe3O4 (72,4 % Fe), ґетит FeOOH (62,9 % Fe), лепідокрокіт FeO(OH) (62,9 % Fe), лімоніт — суміш гідроксидів Fe з SiO2 та ін. речовинами (40-62 % Fe), сидерит FeCO3 (48,2 % Fe), ільменіт FeTiO3 (36,8 % Fe), шамозит (34-42 % FeO), вівіаніт (43,0 % FeO), скородит (34,6 % Fe2О3), ярозит (47,9 % Fe2О3) та ін.
Основні параметри, їх опис та числові значення: Залізо - типовий метал, у вільному стані - сріблясто-білого кольору з сіруватим відтінком. Чистий метал пластичний, різні домішки (зокрема - вуглець) підвищують його твердість і крихкість. Має яскраво вираженими магнітними властивостями. Часто виділяють так звану "тріаду заліза" - групу трьох металів (залізо Fe, кобальт Co, нікель Ni), що володіють схожими фізичними властивостями, атомними радіусами і значеннями електронегативності.
Для заліза характерний поліморфізм, він має чотири кристалічні модифікації:
до 769 ºС існує α-Fe (ферит) з об'ємно центрований кубічної гратами і властивостями феромагнетика (769 ºС ≈ 1043 K - точка Кюрі для заліза)
в температурному інтервалі 769-917 ºС існує β-Fe, який відрізняється від α-Fe тільки параметрами об'ємно центрований кубічної решітки і магнітними властивостями парамагнетика
в температурному інтервалі 917-1394 ºС існує γ-Fe (аустеніт) з грано центрований кубічної гратами
вище 1394 ºС стійко δ-Fe з об'ємно центрований кубічної гратами
Металознавство не виділяє β-Fe як окрему фазу, і розглядає її як різновид α-Fe. При нагріванні заліза або сталі вище точки Кюрі (769 ºС ≈ 1043 K) тепловий рух іонів засмучує орієнтацію спінових магнітних моментів електронів, феромагнетик стає парамагнетиків - відбувається фазовий перехід другого роду, але фазового переходу першого роду зі зміною основних фізичних параметрів кристалів не відбувається.
Для чистого заліза при нормальному тиску, з точки зору металознавства, існують такі стійкі модифікації:
Від абсолютного нуля до 910 ºС стійка α-модифікація з об'ємно центрований кубічної ( ОЦК) кристалічною решіткою.
Від 910 до 1400ºС стійка γ-модифікація з грано центрований кубічної ( ГЦК) кристалічною решіткою.
Від 1400 до 1539 ºС стійка δ-модифікація з об'ємно центрований кубічної ( ОЦК) кристалічною решіткою.
Наявність в стали вуглецю і легуючих елементів істотно змінює температури фазових переходів (див. фазову діаграму залізо - вуглець). Твердий розчин вуглецю в α-і δ-залізі називається феритом. Іноді розрізняють високотемпературний δ-ферит і низькотемпературний α-ферит (або просто ферит), хоча їх атомні структури однакові. Твердий розчин вуглецю в γ-залозі називається аустенітом.
Явище поліморфізму надзвичайно важливо для металургії сталі. Саме завдяки α-γ переходам кристалічної решітки відбувається термообробка стали. Без цього явища залізо як основа стали не одержала б такого широкого застосування.
Залізо тугоплавкої, відноситься до металів середньої активності. Температура плавлення заліза 1539 ºС, температура кипіння - 2862 ºС.
Основні ступеня окислення заліза - +2 і +3.
При зберіганні на повітрі при температурі до 200 ºС залізо поступово покривається щільною плівкою оксиду, що перешкоджає подальшому окисленню металу. У вологому повітрі залізо покривається рихлим шаром іржі, який не перешкоджає доступу кисню і вологи до металу і його руйнування. Іржа не має постійного хімічного складу, наближено її хімічну формулу можна записати як Fe2O3xH2O.
З киснем залізо реагує при нагріванні. При згорянні заліза на повітрі утворюється оксид Fe3O4, при згорянні в чистому кисні - оксид Fe2O3. Якщо кисень або повітря пропускати через розплавлене залізо, то утворюється оксид FeO. При нагріванні порошку сірки і заліза утворюється сульфід, наближену формулу якого можна записати як FeS.
При нагріванні залізо реагує з галогенами. Так як FeF3 нелетуч, залізо стійко до дії фтору до температури 200-300 ºС. При хлоруванні заліза (при температурі близько 200 ºС) утворюється летючий димер Fe2Cl6. Якщо взаємодія заліза і брому протікає при кімнатній температурі або при нагріванні і підвищеному тиску парів брому, то утворюється FeBr3. При нагріванні FeCl3 і, особливо, FeBr3 відокремлюється галоген і перетворюються в галогеніди заліза (II). При взаємодії заліза і йоду утворюється йодид Fe3I8.
При нагріванні залізо реагує з азотом, утворюючи нітрид заліза Fe 3 N, з фосфором, утворюючи фосфіди FeP, Fe2P і Fe3P, з вуглецем, утворюючи карбід Fe3C, з кремнієм, утворюючи кілька силіцидів, наприклад, FeSi.
При підвищеному тиску металеве залізо реагує з оксидом вуглецю (II) CO, причому утворюється рідкий, при звичайних умовах легко летючий пентакарбоніл заліза
Fe(CO)5. Відомі також карбоніли заліза складів Fe2(CO)9 і Fe3(CO)12. Карбоніли заліза служать вихідними речовинами при синтезі залізо органічних сполук, в тому числі і ферроцена складу (η5-C5H5)2Fe.
Чисте металеве залізо стійко у воді і в розбавлених розчинах лугів. Залізо не розчиняється в холодних концентрованих сірчаної та азотної кислотах через пасивації поверхні металу міцної оксидної плівкою. Гаряча концентрована сірчана кислота, будучи більш сильним окислювачем, взаємодіє з залізом.
З соляної і розведеною (приблизно 20%-й) сірчаної кислотами залізо реагує з утворенням солей заліза (II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаємодії заліза з приблизно 70%-й сірчаної кислотою реакція протікає з утворенням сульфату заліза (III) :
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
Оксид заліза (II) FeO володіє основними властивостями, йому відповідає підстава
Fe(OH)2. Оксид заліза (III) Fe2O3 слабо амфотер, йому відповідає ще більш слабке, ніж Fe(OH)2, підстава Fe(OH)3, що реагує з кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Гідроксид заліза (III) Fe(OH)3 проявляє слабо амфотерні властивості, він здатний реагувати лише з концентрованими розчинами лугів:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
Утворені при цьому гідро комплекси заліза (III) стійкі в сильно лужних розчинах. При розведенні розчинів водою вони руйнуються, причому в осад випадає Fe(OH)3.
З'єднання заліза (III) у розчинах відновлюються металевим залізом:
Fe + 2FeCl3 → 3FeCl2.
При зберіганні водних розчинів солей заліза (II) спостерігається окислення заліза (II) до заліза (III):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
З солей заліза (II) у водних розчинах стійка сіль Мора - подвійний сульфат амонію та заліза (II) (NH4)2 Fe(SO4)2+6Н2O.
При дії газоподібного хлору або озону на лужні розчини сполук заліза (III) утворюються сполуки заліза (VI) - Ферати, наприклад, Ферати (VI) калію K2FeO4. Є повідомлення про отримання під дією сильних окислювачів сполук заліза (VIII).
Для виявлення в розчині сполук заліза (III) використовують якісну реакцію іонів
Fe3 + з тіоціанат-іонами SCN -. При взаємодії іонів Fe3+ з аніонами SCN - утворюється яскраво-червоний роданид заліза Fe(SCN)3. Іншим реактивом на іони Fe3+ служить гексаціаноферрат (II) калію K4[Fe(CN)6] (жовта кров'яна сіль). При взаємодії іонів Fe3+ і [Fe(CN)6]4 - випадає яскраво-синій осад берлінської блакиті :
4K4[Fe(CN)6] + 4Fe3+ → 4KFe(III)[Fe(II) (CN)6]↓ + 12K+.
Реактивом на іони Fe2+ в розчині може служити гексаціаноферрат (III) калію
K3[Fe (CN)6] (червона кров'яна сіль). При взаємодії іонів Fe2+ і [Fe(CN)6]3 - випадає осад турнбулевой сини :
3K3[Fe(CN)6] + 3Fe2+ → 3KFe(III)[Fe(II) (CN)6]↓ + 6K+.
Застосування: Залізо - один з найбільш використовуваних металів, на нього припадає до 95% світового металургійного виробництва.
Залізо є основним компонентом сталей і чавунів - найважливіших конструкційних матеріалів.
Залізо може входити до складу сплавів на основі інших металів - наприклад, нікелевих.
Магнітна окис заліза (магнетит) - важливий матеріал у виробництві пристроїв довготривалої комп'ютерної пам'яті: жорстких дисків, дискет і т. п.
Ультрадисперсних порошок магнетиту використовується в чорно-білих лазерних принтерах як тонера.
Унікальні феромагнітні властивості ряду сплавів на основі заліза сприяють їх широкому застосуванню в електротехніці для магнітопроводів трансформаторів та електродвигунів.
Хлорид заліза (III) (хлорне залізо) використовується в радіоаматорського практиці для травлення друкованих плат.
Семіводний сульфат заліза ( залізний купорос) у суміші з мідним купоросом використовується для боротьби з шкідливими грибками в садівництві та будівництві.
Залізо застосовується в якості анода в залізо-нікелевих акумуляторах, залізо-повітряних акумуляторах.
Водні розчини хлоридів двовалентного і тривалентного заліза, а також його сульфатів використовуються як коагулянтів у процесах очищення природних і стічних вод на водопідготовці промислових підприємств.
Вікалой 11
Визначення: Вікалой – магнітотвердий сплав ванадію, кобальту і заліза.
Класифікація: Вікалой відноситься до ковких магнітотвердих сплавів, з яких можна виготовляти стрічку і дріт.
Основні параметри: 34% заліза, 52% кобальту, 14% ванадію
Числові значення параметрів: Нс= 36А/м при Br=1 Тл.
Застосування: Використовують для звукозапису, але не в широкому діапазоні частот (особливо у високочастотному діапазоні). Для виконання цих вимог використовують магнетит. Як магнітний матеріал використовується магнітна стрічка з ацетилцелюлози з покриттям з магнетиту (оксид заліза Fe3O4).