
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ 2
Глава 1. Общие понятия о реальных газах 2
1.1 Общее понятие о реальном газе 2
1.2 Уравнение Ван-дер-Ваальса - ретроспектива 5
Глава 2. Практическое применение уравнения реальных газов 8
2.1 Расчет отдельных параметров реальных газов 8
2.2 Практическое применение уравнения Ван-дер-Ваальса 15
ЗАКЛЮЧЕНИЕ 19
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ 21
ВВЕДЕНИЕ
Реальный газ - в общем случае - газообразное состояние реально существующего вещества. В термодинамике под реальным газом, понимается газ, который не описывается в точности уравнением Клапейрона - Менделеева, в отличие упрощенной его модели - гипотетического идеального газа, строго подчиняющегося вышеуказанному уравнению. Обычно под реальным газом понимают газообразное состояние вещества во всем диапазоне его существования. Однако, существует и другая классификация, по которой реальным газом называется высоко перегретый пар, состояние которого незначительно отличается от состояния идеального газа, а к парам относят перегретый пар, состояние которого заметно отличается от идеального газа, и насыщенный пар (двухфазовая равновесная система жидкость - пар), который вообще не подчиняется законам идеального газа.
С позиции молекулярной теории строения вещества реальный газ - это газ, свойства которого зависят от взаимодействия и размеров молекул. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определённый объём. Состояние реального газа часто на практике описывается обобщённым уравнением Клапейрона – Менделеева.
Цель работы – рассмотреть особенности уравнения реальных газов.
Предмет исследования – реальные газы.
В ходе выполнения работы будут исследованы следующие вопросы: общие понятия о реальных газах и практическое исследование и расчеты реальных газов.
Методологической базой для исследования являются труды отечественных и зарубежных авторов
Глава 1. Общие понятия о реальных газах
1.1 Общее понятие о реальном газе
Термин «реальный газ» обычно относится к газу, который не ведет себя как идеальный газ. Их поведение можно объяснить взаимодействиями между газовыми молекулами. Эти межмолекулярные взаимодействия между частицами газа являются причиной того, что реальные газы не подчиняются закону идеального газа. Следовательно, реальные газы можно определить как неидеальные газы, молекулы которых занимают определенное пространство и обладают способностью взаимодействовать друг с другом. [7]
Важно отметить, что в большинстве случаев поведение реального газа почти такое же, как и у идеального газа. Поэтому во многих приложениях нет необходимости в подробном анализе отклонения реальных газов от идеального поведения. Достаточно точные расчеты можно провести, применив уравнение идеального газа к этим реальным газам. Однако важно отметить, что газ следует рассматривать как настоящий газ, когда он приближается к точке конденсации. Кроме того, почти все газы следует рассматривать как реальные газы, поскольку они приближаются к своим критическим точкам. Другие ситуации, в которых газы могут рассматриваться как реальные газы, включают ситуации, в которых давление, приложенное к газу, очень высокое, и для объяснения эффекта Джоуля-Томсона. Также важно отметить, что отклонение реального газа от поведения идеального газа может быть выражено через коэффициент сжимаемости (также известный как коэффициент отклонения газа или коэффициент сжатия; обычно обозначается символом 'Z'). [8]
Важно понимать, что почти все газы могут вести себя как реальные газы, когда они помещены в соответствующие условия. Например, при стандартных условиях температуры и давления (обычно сокращенно STP) поведение воздуха можно оценить с помощью закона идеального газа. Это связано с тем, что воздух ведет себя как идеальный газ при стандартных условиях температуры и давления. Однако, когда давление, прикладываемое к воздуху, увеличивается до очень большой величины, тот же воздух начинает демонстрировать заметные отклонения от закона идеального газа и начинает демонстрировать поведение, подобное поведению реального газа. Более того, любое повышение абсолютной температуры газа также может иметь аналогичный эффект. Это связано с тем, что увеличение абсолютной температуры газа приводит к увеличению средней кинетической энергии молекул газа. Это, в свою очередь, приводит к увеличению количества взаимодействий между молекулами газа. Следовательно, повышение абсолютной температуры воздуха также может вызывать заметные отклонения от идеального поведения и превращать его в настоящий газ.
Таким образом, почти все газы могут вести себя как идеальные газы, а также как реальные газы. Когда условия относительно окружающие, большинство газов, как известно, демонстрируют почти идеальное поведение. Однако в относительно экстремальных условиях, в которых либо температура газа повышается до очень высокого значения, давление на газ повышается до очень высокого значения, либо температура и давление, связанные с газом, повышаются до чрезвычайно высоких значений. При высоких значениях большинство газов будет отклоняться от идеального поведения и превращаться в реальные газы.
Реальные газы - это газы, которые не подчиняются закону идеального газа, тогда как все идеальные газы должны подчиняться уравнению идеального газа. Кроме того, идеальный газ должен подчиняться всем газовым законам при любых условиях, но реальный газ может не подчиняться отдельным газовым законам в определенных условиях (которые являются относительно экстремальными). Также можно отметить, что реальные газы имеют тенденцию к сжижению при охлаждении до температур ниже их точек кипения.
Уравнение идеального газа можно преобразовать в уравнение Ван-дер-Ваальса, чтобы учесть причины, по которым реальные газы не ведут себя идеальным образом. Это уравнение учитывает объем, занимаемый молекулами реального газа, а также взаимодействия между молекулами реальных газов (силы притяжения и отталкивания, возникающие между ними). [6]
1.2 Уравнение Ван-дер-Ваальса - ретроспектива
Уравнение Ван-дер-Ваальса - это термодинамическое уравнение состояния, основанное на теории, согласно которой жидкости состоят из частиц с ненулевым объемом и подвержены (не обязательно попарно) силе притяжения между частицами. работа в области теоретической физической химии, выполненная в конце 19 века Иоганнесом Дидериком ван дер Ваальсом, который выполнил соответствующую работу по силе притяжения, которая также носит его имя. Известно, что уравнение основано на традиционном наборе выводов. из Ван дер Ваальса и связанных с ним усилий, а также набор выводов, основанных на статистической термодинамике. [5]
Ранние интересы Ван дер Ваальса были в основном в области термодинамики, где первое влияние оказала опубликованная работа Рудольфа Клаузиуса о тепле в 1857 году; Другим значительным влиянием были сочинения Джеймса Клерка Максвелла, Людвига Больцмана и Уилларда Гиббса.
После первоначального поиска дипломов преподавателя, бакалаврская работа Ван дер Ваальса по математике и физике в Лейденском университете в Нидерландах привела (со значительными препятствиями) к его принятию в докторантуру в Лейдене под руководством Питера Рийке. В то время как его диссертация помогает объяснить экспериментальное наблюдение в 1869 году ирландским профессором химии Томасом Эндрюсом (Королевский университет Белфаста) существования критической точки в жидкостях, историк науки Мартин Дж. Кляйн утверждает, что неясно, знал ли Ван дер Ваальс о результатах Эндрюса, когда он начинал свою докторскую работу [4].
Докторантура Ван дер Ваальса завершилась диссертацией 1873 года, в которой была предложена полуколичественная теория, описывающая изменение состояния газ-жидкость и происхождение критической температуры, Over de Continuïteit van den Gas-en Vloeistof [-] toestand (голландский; на русском языке: О непрерывности газового и жидкого состояния); Именно в этой диссертации появились первые выводы того, что мы теперь называем уравнением Ван-дер-Ваальса [5].
Джеймс Клерк Максвелл рассмотрел и похвалил опубликованный контент в британском научном журнале Nature, а Ван дер Ваальс начал независимую работу, которая привела к получению ему Нобелевской премии в 1910 году, в которой подчеркивался вклад его формулировки это «уравнение состояния для газов и жидкостей».
Уравнение Ван-дер-Ваальса математически просто, но, тем не менее, оно предсказывает экспериментально наблюдаемый переход между паром и жидкостью, а также предсказывает критическое поведение. Оно также адекватно предсказывает и объясняет эффект Джоуля-Томсона (изменение температуры во время адиабатического расширения), что невозможно в идеальном газе.
Выше критической температуры TC уравнение Ван-дер-Ваальса является улучшением по сравнению с законом идеального газа, а для более низких температур, то есть T
Это кажущееся несоответствие разрешается в контексте парожидкостного равновесия: при определенной температуре существуют две точки на изотерме Ван-дер-Ваальса, которые имеют одинаковый химический потенциал, и, таким образом, система в термодинамическом равновесии будет пересекать прямую линию на p – V-диаграмме при изменении отношения пара к жидкости. Однако в такой системе на самом деле присутствуют только две точки (жидкость и пар), а не серия состояний, соединенных линией, поэтому соединение геометрического места точек неверно: это не уравнение нескольких состояний, а уравнение (единственного) состояния. Действительно, возможно сжимать газ выше точки, в которой он обычно конденсируется, при правильных условиях, а также можно расширять жидкость выше точки, в которой она обычно кипит. Такие состояния называются «метастабильными» состояниями. Такое поведение качественно (хотя, возможно, и не количественно) предсказывается уравнением состояния Ван-дер-Ваальса.
Однако значения физических величин, предсказанные с помощью уравнения состояния Ван-дер-Ваальса, «очень плохо согласуются с экспериментом», поэтому полезность модели ограничивается качественными, а не количественными целями. Эмпирически обоснованные поправки могут быть легко вставляется в модель Ван-дер-Ваальса, но при этом модифицированное выражение перестает быть простой аналитической моделью; в этом отношении другие модели, такие как модели, основанные на принципе соответствующих состояний, достигают лучшего соответствия примерно с той же работой.
Даже с его признанными недостатками, повсеместное использование уравнения Ван-дер-Ваальса в стандартном университете Учебники по физической химии ясно показывают его важность как педагогического инструмента, помогающего понять фундаментальные идеи физической химии, участвующие в разработке теорий поведения пара-жидкости и уравнений состояния.
Кроме того, другие (более точные) уравнения состояния, такие как уравнение состояния Редлиха – Квонга и Пенга – Робинсона, по существу являются модификациями уравнения состояния Ван-дер-Ваальса. [11]
Глава 2. Практическое применение уравнения реальных газов
2.1 Расчет отдельных параметров реальных газов
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ.
р΄=а/V2 (1)
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, или, иными словами, против внутреннего давления, как известно из механики, идёт на увеличение потенциальной энергии системы.
Т.е. dA=p΄Vm=dП, или dП=a/V2m*dVm, откуда П=-а/Vm (2)
Знак минус означает, что молекулярные силы, создающие внутреннее давление р΄, являются силами притяжения. Если газ расширяется без теплообмена с окружающей средой и не совершает внешней работы, то на основании первого начала термодинамики получим, что U1=U2. Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Использование выражения для внутренней энергии идеального газа позволяет записать формулу, для расчета внутренней энергии газа Ван-дер-Ваальса в виде:
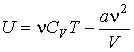 (3)
(3)Как следует из этого выражения, внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им. По этой причине, при осуществлении изотермических процессов в газе Ван-дер-Ваальса, будет изменяться его внутренняя энергия, а, следовательно, при таких процессах подведенная к газу теплота не будет равна совершенной им работе.
Если внутренняя энергия идеального газа определяется кинетической энергией его молекул, то для газа Ван-дер-Ваальса существенное значение имеет потенциальная энергия, обусловленная силами притяжения и отталкивания. Согласно первому началу термодинамики изменение внутренней энергии газа может быть осуществлено либо сообщением ему теплоты, либо совершением над ним механической работы. Если газ адиабатически расширяется, не совершая механической работы, его внутренняя энергия остается неизменной. Для идеального газа неизменность внутренней энергии эквивалентна постоянству температуры газа. [5-11]
Термодинамические свойства реальных газов. Как известно, уравнение состояния устанавливает функциональную связь между давлением p, объемом V, температурой T и числом молей n газа в состоянии равновесия. Эта связь может выражаться не только в форме уравнения, но также графически или в виде таблиц, которые часто используются, особенно для практических целей. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
pV = nRT, (4)
где R – универсальная газовая постоянная.
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации.
Так, для газов с низкой температурой сжижения (He, H2, Ne и даже N2, O2, Ar, CO, CH4) при давлениях до 50 атм отклонения не превышают 5%, а при давлениях до 10 атм – 2%. Легко конденсирующиеся газы (CO2, SO2, Cl2, CH3Cl) уже при 1 атм обнаруживают отклонения до 2 – 3%.
Одной из наглядных характеристик отклонений реальных газов от идеального поведения оказывается мольный объем газа Vm = V/n. Для идеального газа он равен 22,414 л при 1 атм и 273 K. Наиболее удобной мерой неидеальности является фактор сжимаемости Z = pVm/RT, поскольку для идеального газа Z = l при любых условиях.

Рисунок. 1 Зависимость фактора сжимаемости некоторых газов от давления при 298 К
На рис. 1 представлены факторы сжимаемости для некоторых реальных газов как функции давления при 298 К (для сравнения поведение идеального газа показано пунктиром). При высоких давлениях для всех газов Z > 1, т.е. их труднее сжать, чем идеальный газ, поскольку в этой области преобладают силы межмолекулярного отталкивания. Из рисунка видно, что при более низких давлениях для некоторых газов Z < 1, что объясняется преобладанием межмолекулярного притяжения. При p → 0 эффект межмолекулярного притяжения исчезает, потому что расстояние между молекулами стремится к бесконечности, и для всех газов Z → 1, т.е. в этих условиях все газы ведут себя почти идеально.
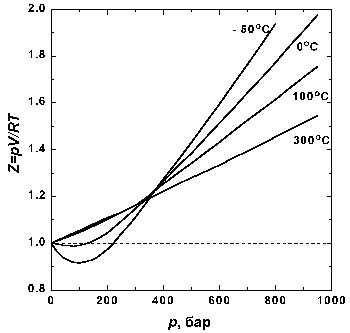
Рисунок 2. Зависимость фактора сжимаемости N2 от давления при разных температурах
На рис. 2 представлены факторы сжимаемости для азота при разных температурах. По мере уменьшения температуры эффект межмолекулярного притяжения увеличивается (что проявляется в образовании минимума на кривых в области давлений около 100 бар). Минимум на кривых обнаруживается для всех газов, если температура достаточно низка. У водорода и гелия, имеющих очень низкие температуры кипения, этот минимум наблюдается только при температурах значительно ниже 0° C.
Из приведенных данных видно, что при низких давлениях реальные газы могут быть более сжимаемыми (Z < 1), чем идеальный газ, а при высоких – менее (Z > 1). Очевидно, что основными причинами отклонений свойств реальных газов от свойств идеального газа оказываются взаимное притяжение молекул и наличие у них собственного объема. Наиболее ярко межмолекулярное притяжение в реальных газах проявляется в их способности к конденсации – переходу в жидкое состояние.
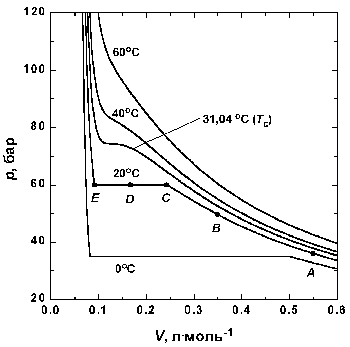
Рисунок 3. Экспериментальные изотермы для СО2
Вблизи точки А давление возрастает приблизительно по закону Бойля. Заметные отклонения от закона Бойля начинают наблюдаться, когда объем становится соизмеримым со значением, указанным точкой В. В точке С сходство с идеальным поведением полностью теряется, так как оказывается, что дальнейшее уменьшение объема не вызывает роста давления; это показано горизонтальной линией CDE. Исследование содержания сосуда показывает, что сразу за точкой С появляется жидкость, и можно наблюдать две фазы, разделенные резко обозначенной границей – поверхностью раздела. Поскольку при уменьшении объема газ конденсируется, он не оказывает сопротивления дальнейшему движению поршня. Давление, соответствующее линии CDE, когда жидкость и пар находятся в равновесии, называется давлением пара жидкости при температуре опыта.
В точке Е весь образец представляет собой жидкость, и дальнейшее уменьшение объема образца требует значительного давления, поскольку жидкости по сравнению с газами очень трудно сжимаются, что проявляется в резком подъеме кривой слева от точки Е.
Поскольку критические константы являются характеристическими свойствами газов, их можно использовать для создания соответствующей относительной шкалы, введя безразмерные приведенные переменные: приведенное давление pr(π), приведенный объем Vr(φ) и приведенную температуру Tr(τ):
Соответственными называются состояния разных веществ, имеющие одинаковые значения приведенных переменных. Согласно закону соответственных состояний, если для рассматриваемых веществ значения двух приведенных переменных одинаковы, должны совпадать и значения третьей приведенной переменной. Таким образом, уравнения состояния различных веществ, записанные в приведенных переменных, должны совпадать. Это утверждение эквивалентно постулату о существовании общего универсального приведенного уравнения состояния: F(pr, Vr, Tr) = 0
Поскольку это приведенное уравнение не содержит в явном виде индивидуальных постоянных, оно должно быть применимо к любому веществу. Закон соответственных состояний является общим утверждением, не связанным с конкретным видом уравнения состояния. На практике закон соответственных состояний приближенно выполняется для однотипных веществ, что позволяет, например, использовать для реальных газов обобщенные диаграммы сжимаемости.
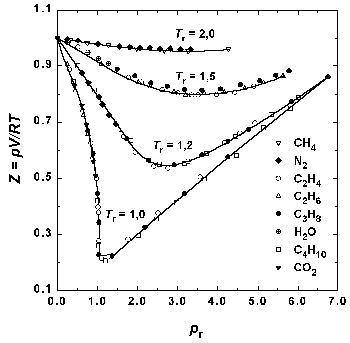
Рисунок 4. Зависимость фактора сжимаемости некоторых газов от приведенного давления при разных приведенных температурах
Можно показать, что любое уравнение состояния, содержащее три параметра, можно представить в приведенной форме. Для тех из них, которые содержат три параметра, представлена также и приведенная форма. Отсутствие универсального уравнения F(pr, Vr, Tr) = 0 говорит не о неверности закона о соответственных состояниях, а о недостаточности двух индивидуальных постоянных и R в уравнении состояния.
В настоящее время понятно, почему в уравнениях состояния реальных газов двух индивидуальных параметров в общем случае не хватает, но в первом приближении этого достаточно. Причиной всех отклонений от уравнения состояния идеального газа являются межмолекулярные взаимодействия в газах.
Статистический расчет показывает, что наличие индивидуальных постоянных в уравнении межмолекулярного взаимодействия всегда приводит к появлению индивидуальных постоянных и в уравнении состояния газов. Поэтому в области значений p, V и T, для которых в реальных газах вклад межмолекулярных взаимодействий достаточно велик, в уравнениях состояния появляются индивидуальные постоянные, зависящие от параметров уравнении межмолекулярного взаимодействия. Поэтому в приближенных уравнениях состояния часто оказывается достаточно использовать две индивидуальные постоянные. Если же требуется описать поведение газа с более высокой точностью, необходимо использовать уравнения с большим числом постоянных. Так, например, уравнение Битти – Бриджмена содержит пять постоянных кроме R и считается одним из лучших эмпирических уравнений состояния. В течение некоторого времени оно применялось при составлении справочных таблиц реальных газов. В настоящее время для возможно более точного описания свойств газов используют эмпирическое уравнение Бенедикта – Вебба – Рубина:
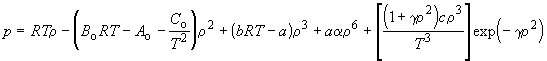 (6)
(6)2.2 Практическое применение уравнения Ван-дер-Ваальса
С помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость и проанализировать критические явления. В этом отношении уравнение Ван-дер-Ваальса имеет преимущество даже перед более точными уравнениями в вириальной форме.
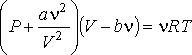 (7)
(7)где:
Пусть на молекулы газа действуют силы притяжения и отталкивания. И те, и другие силы действуют на небольших расстояниях, но силы притяжения убывают медленнее сил отталкивания. Силы притяжения относятся к взаимодействию молекулы с её ближайшим окружением, а сила отталкивания - проявляется в момент столкновения двух молекул.
Силы притяжения внутри газа в среднем скомпенсированы для каждой отдельной молекулы. На молекулы, расположенные в тонком слое вблизи стенки сосуда, действует сила притяжения со стороны других молекул, направленная внутрь газа, которая создает давление, добавочное к создаваемому самой стенкой. Это давление иногда называют внутренним давлением.
Суммарная сила внутреннего давления, действующая на элемент поверхностного слоя газа, должна быть пропорциональна числу молекул газа в этом элементе и также числу молекул в слое газа, непосредственно примыкающему к рассматриваемому элементу поверхностного слоя. Толщина этих слоёв определяется радиусом действия сил притяжения и имеет тот же порядок величины. При увеличении концентрации молекул газа в
где:
Вводя обозначение:
где:
Итак, нами получен вид поправки к давлению, которая необходима для того, чтобы учесть слабые силы притяжения в реальном газе, отличающие его от идеального. При этом в формуле для нахождения суммарного давления внутри газа
Рассмотрим теперь поправку, связанную с действием сил отталкивания. Поскольку нами будут учитываться только парные взаимодействия между молекулами, то эта сила, в отличие от силы притяжения, не будет зависеть от концентрации молекул. По этой же причине сила отталкивания проявляется во всём объёме газа, а не только в приповерхностном слое. Зависимость этой силы от расстояния между молекулами определяет эффективное сечение взаимодействия молекул, то есть, по сути, их размеры.
Таким образом, в случае проявления короткодействующих сил отталкивания, невозможно аппроксимировать молекулы материальными точками и пренебречь их размерами. Поэтому необходимо ввести поправку, учитывающую объём, занимаемый молекулами. Её величина будет пропорциональна общему числу молекул
где:
представим формулу (11) в виде:
Величину
Если теперь в левой части уравнения Клапейрона-Менделеева:
произвести замену произведения
 (15)
(15)то получится уравнение Ван-дер-Ваальса.
Введение поправки, обусловленной действием сил притяжения, привело к тому, что уравнение состояния стало кубическим относительно объёма, а число постоянных, являющихся его параметрами, стало равным трем. Как известно, кубическое уравнение имеет три корня. Для уравнения Ван-дер-Ваальса имеют место два следующих случая: а) корни действительны; б) два корня мнимые и один корень действительный.

Рисунок 5. Визуализация уравнения Ван-дер-Ваальса
ЗАКЛЮЧЕНИЕ
Таким образом, реальные газы - это все газы, которые существуют в природе, за исключением тех случаев, когда они находятся в условиях определенного давления и температуры, и в этих случаях они рассматриваются приблизительно для целей упрощенных расчетов как идеальные или идеальные газы. В отличие от идеальных газов, реальные газы не могут быть полностью объяснены и смоделированы с использованием закона идеального газа.
Благородные газы, такие как гелий и аргон, поскольку они являются атомарными газами, обычно не образующими молекулы, они ближе к идеальным газам и поэтому, даже ошибочно, в прошлом назывались «идеальными газами», поскольку их частицы ведут себя больше, как идеализированные и точные характеристики идеальных газов.
Чтобы понять и смоделировать реальные газы, необходимо учитывать несколько условий, например:
Эффекты сжимаемости;
Переменная удельная теплоемкость;
Силы Ван-дер-Ваальса;
Эффекты не термодинамического равновесия;
Проблемы молекулярной диссоциации и элементарных реакций переменного состава.
Для большинства приложений такой подробный анализ не нужен, и приближение идеального газа можно использовать с разумной точностью. Модели реального газа должны использоваться вблизи точек конденсации газа, вблизи критической точки, при очень высоких давлениях и в некоторых других, менее обычных случаях.
Для физической обработки реальных газов было предложено несколько уравнений состояния, подходящих для реальных газов:
Вириальное уравнение;
Уравнение Ван-дер-Ваальса;
Уравнение Бертело;
Уравнение Дитеричи.
Для большинства приложений такой подробный анализ не нужен, и приближение идеального газа можно использовать с разумной точностью. С другой стороны, модели реального газа должны использоваться вблизи точки конденсации газов, вблизи критических точек, при очень высоких давлениях, чтобы объяснить эффект Джоуля – Томсона и в других, менее обычных случаях. Отклонение от идеальности можно описать коэффициентом сжимаемости Z.
Кроме того, уравнение Ван-дер-Ваальса - это уравнение состояния для газов, с помощью которого поведение реальных газов может быть описано более точно, чем с помощью общего газового уравнения для идеального газа. Выходя за рамки общего уравнения газа, уравнение Ван-дер-Ваальса содержит два параметра для сил отталкивания и притяжения между частицами газа. Это характерно для соответствующего газа. Таким образом, это приводит к простому и приблизительно количественному пониманию сжижения и многих других свойств, в которых реальные газы отличаются от идеального газа. Уравнение было установлено в 1873 году Иоганнесом Дидериком ван дер Ваальсом, за что он получил Нобелевскую премию по физике в 1910 году.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Авдеева, Л.В. Биохимия: Учебник / Л.В. Авдеева, Т.Л. Алейникова, Л.Е. Андрианова; под ред. Е.С. Северин. - М.: ГЭОТАР-МЕД, 2016. - 768 c.
Алов, Н.В. Аналитическая химия и физико-химические методы анализа. В 2-х т.: Учебник / Н.В. Алов. - М.: ИЦ Академия, 2016. - 768 c.
Артемов, А.В. Физическая химия: Учебник для студентов учреждений высшего профессионального образования / А.В. Артемов. - М.: ИЦ Академия, 2016. - 288 c.
Ауэрман, Т.Л. Основы биохимии: Учебное пособие / Т.Л. Ауэрман, Т.Г. Генералова, Г.М. Суслянок. - М.: НИЦ ИНФРА-М, 2018. - 400 c.
Бабкина, С.С. Общая и неорганическая химия. Лабораторный практикум: Учебное пособие для бакалавров и специалистов / С.С. Бабкина, Р.И. Росин, Л.Д. Томина. - М.: Юрайт, 2016. - 481 c.
Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. - М.: ИЦ РИОР, 2017. - 272 c.
Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. - М.: Альфа-М, НИЦ ИНФРА-М, 2016. - 336 c.
Боровлев, И.В. Органическая химия: термины и основные реакции / И.В. Боровлев. - М.: БИНОМ. ЛЗ, 2018. - 359 c.
Бокуть, С.Б. Биохимия филогенеза и онтогенеза: Учебное пособие / А.А. Чиркин, Е.О. Данченко, С.Б. Бокуть; под общ. ред. А.А. Чиркин. - М.: НИЦ ИНФРА-М, Нов. знание, 2017. - 288 c.
Валова, (Копылова) В Аналитическая химия и физико-химические методы анализа: Практикум / (Копылова) В.Д. Валова. - М.: Дашков и К, 2016. - 200 c.
Гидранович, В.И. Биохимия: Учебное пособие / В.И. Гидранович, А.В. Гидранович. - Мн.: ТетраСистемс, 2016. - 528 c.
Голощапов, А.П. Генетико-биохимические аспекты адаптации человека к условиям города с развитой химической промышленностью / А.П. Голощапов. - М.: КМК, 2016. - 103 c.
Голощапов, А.П. Генетико-биохимические аспекты адаптации человека к условиям города с развитой химической промышленностью / А.П. Голощапов. - М.: КМК, 2017. - 103 c.
Глубоков, Ю.М. Аналитическая химия: Учебник для студентов учреждений среднего профессионального образования / Ю.М. Глубоков, В.А. Головачева, Ю.А. Ефимова; под ред. А.А. Ищенко. - М.: ИЦ Академия, 2016. - 320 c.
Димитриев, А.Д. Биохимия: Учебное пособие / А.Д. Димитриев, Е.Д. Амбросьева. - М.: Дашков и К, 2018. - 168 c.
Жебентяев, А.И. Аналитическая химия. Хроматографические методы анализа: Учебное пособие / А.И. Жебентяев. - М.: НИЦ ИНФРА-М, Нов. знание, 2017. - 206 c.