
Ім'я файлу: Курсач.docx
Розширення: docx
Розмір: 348кб.
Дата: 22.05.2021
скачати
Пов'язані файли:
Документ Microsoft Word (3).docx
Розширення: docx
Розмір: 348кб.
Дата: 22.05.2021
скачати
Пов'язані файли:
Документ Microsoft Word (3).docx
ЗМІСТ
| ВСТУП | 5 |
| РОЗДІЛ 1. ЗАГАЛЬНА ЧАСТИНА | 7 |
| Огляд літератури | 7 |
| 1.2 Обгрунтування цілей | 13 |
| РОЗДІЛ 2 ТЕХНОЛОГІЧНА ЧАСТИНА | 14 |
| 2.1 Характеристика готового продукту | 14 |
| 2.2 Характеристика біологічного агенту,сировини та допоміжних речовин | 14 |
| 2.3. Блок-схема виробництва | 18 |
| 2.4 Опис біотехнологічного процесу | 19 |
| 2.5 Норми біотехнологічного процесу | 23 |
| 2.6 Матеріальний баланс | 28 |
| 2.7 Матеріальні розрахунки | 29 |
| 2.7.1 Розрахунок основного обладнання | 29 |
| 2.7.2 Розрахунок допоміжного обладнання | 36 |
| 2.8 Апаратурно технологічна схема | 42 |
| Висновок | 44 |
| Список використаної літератури | 45 |
ВСТУП
На сьогодні головним джерелом отримання ліполітичних ферментних препаратів є широке коло мікроорганізмів різних таксономічних груп, генетична вивченість більшості з яких дає змогу здійснювати маніпуляції щодо підвищення виходу цільового продукту. Проведений літературний, зокрема патентний, пошук сучасних продуцентів виявив серед них бактерії, актиноміцети, дріжджі та мікроскопічні гриби. Основну частину промислово важливих ферментів світового ринку на сьогодні становлять гідролази.
Ліпази (триацилгліцеролгідролази КФ 3.1.1.3) як гідролітичні ферменти можуть використовуватись у багатьох галузях господарства, де необхідний частковий або повний гідроліз жирів та олій. Вони широко застосовуються в харчовій, фармацевтичній та легкій промисловості, у медицині, у препаративній хімії та біохімії, у виробництві мийних засобів, для очищення стічних вод і каналізаційних комунікацій. Ліпази викликають великий інтерес у науковців у зв’язку зі своїми унікальними властивостями, а саме дією на поверхні поділу фаз, різноманітністю субстратної специфічності, здатністю каталізувати як гідроліз тригліцеридів, так і зворотні реакції у мікроводневих умовах. Ліполітичні ферменти поширені в організмах різного рівня біологічної організації, але вирішити технологічні завдання можна тільки за допомогою їх мікробного синтезу.
Науковці різних країн працюють з широким колом мікробних продуцентів, підбираючи для кожного умови культивування, та очистки. На сьогодні в Україні промислове виробництво ферментів ліполітичного комплексу не налагоджено. Стримуючим фактором у виробництві ліпаз є відсутність стабільних високоактивних промислово цінних продуцентів з новими властивостями, необхідними для тієї чи іншої галузі .
Метою роботи є розглянути мікроорганізми різних систематичних груп – продуцентів ліполітичних ферментів. Звернути увагу на поняття мікроорганізмів та ферментів. Ознайомитися з джерелом отримання ферментних препаратів. Вивчити ліполітичні ферменти, їх класифікацію, субстратну специфічність, застосування ферментів ліполітичного комплексу та їх виробництво.
РОЗДІЛ 1. ЗАГАЛЬНА ЧАСТИНА
Огляд літератури
Ліполітичні ферменти відіграють виключно важливу роль у обміні ліпідів всіх живих організмів. Вони приймають участь у процесах накопичення та мобілізації жиру, який використовується в якості енергетичного резерву клітини; крім того, включаючись до метаболізму внутрішньоклітинних ліпідів, вони приймають участь у функціонуванні біологічних мембран.
Ліполітичними ферментами називають гідролази ефірів жирних кислот з довгим ланцюгом, тобто насичені чи ненасичені аліфатичні кислоти, що містять не менш ніж 12 атомів вуглецю. Оскільки за хімічними, фізичними та біологічними властивостями найбільш “типова” жирна кислота – це олеїнова кислота, то довільну естеразу, яка має здатність гідролізувати ефіри олеїнової кислоти, можна вважати ліполітичним ферментом. Спиртова група такого ефіру може бути представлена або гліцерином (ліпази), або його похідним (фосфоліпази 1 та 2, лізофосфоліпаза, галактоліпаза), або стеарином (холестерол-естераза). Всі ці ефіри належать до природних або фізіологічних субстратів, однак більшість ліполітичних ферментів можуть гідролізувати також штучно отримані ефіри, часто із зовсім іншою структурою[11].
За класифікацією, рекомендованою Міжнародним біохімічним союзом, всі ліполітичні ферменти відносять до класу гідролаз (клас 3), крім того всі ліполітичні ферменти є гідролазами ефірів, тобто належать до підкласу 1. Ліполітичні ферменти гідролізують ефіри жирних кислот, тобто відносяться до підкласу гідролаз ефірів карбонових кислот (КФ 3.1.1). Фосфоліпази, включені до групи ліполітичних ферментів, належать до підкласу гідролаз фосфодіефірів (КФ 3.1.4), а фосфатидфосфогідролаза – до підкласу фосфомоноефірів (КФ 3.1.3).
Розглядаючи класифікацію ліполітичних ферментів докладніше можна виділити такі основні групи цих ферментів:
Гідролази ефірів гліцерину (КФ 3.1.1.3) – це власне “ліпази”, тобто ацилгідролази вищих тригліцеридів. Позиційна специфічність по відношенню до первинних ефірних зв’язків присутня, але не в усіх випадках.
Як правило ці ферменти можуть гідролізувати також ді- та моногліцериди. Найвідомішим представником цієї групи є панкреатична ліпаза.
Холестерол-естераза гідролаза стиролових ефірів (КФ 3.1.1.13), можливо ідентична моногліцеридліпазі, але це питання ще остаточно не вирішене.
Фосфоліпаза-2-фосфатид–2-ацилгідролаза (КФ 3.1.1.4), її називають ще лецитіназа або фосфоліпаза А, належить до ліполітичних ферментів із чіткою субстратною специфічністю; ферменти цієї групи гідролізують ацилефірний зв’язок в 3-фосфогліцеридах лише в положенні 2.
Лізофосфоліпази лізолецитин–ацилгідролаза (КФ 3.1.1.5), специфічно гідролізуючи в лізофосфоліпідах ефірний зв’язок в положенні 1 або 2, можливо існують, однак поки ще така специфічність не виявлена; є привід вважати, що “лізофосфоліпази” є ферментами з дуже широкою специфічністю, тому їх можна віднести до групи амфіфільних гідролаз ефірів карбонових кислот.
Фосфогідролази: фосфатидат–фосфогідролаза (КФ 3.1.3.4), фосфоліпаза 3 (КФ 3.1.4.3), яка гідролізує в фосфогліцеридах фосфоефірний зв’язок в положенні 3, та сфінгомієлаза (КФ 3.1.4.–), яка гідролізує відповідний зв’язок в сфінгомієліні. Не виключено, що існують ферменти, які мають активність як фосфоліпази 3, так і сфінгомієлази. Фосфоліпази 4 фосфатидилхолін–фосфатидогідролаза (КФ 3.1.4.4) каталізують гідролітичне відщеплення гідрофільного спирту як від фосфогліцеридів, так і від сфінгомієлінів.
Субстратна специфічність ліпази включає:
– позиційну специфічність, тобто здатність гідролізувати в тригліцеридах лише первинні, або первинні та вторинні ефірні зв’язки;
– стерео специфічність, тобто здатність (гіпотетичну) гідролізовати складноефірний зв’язок лише в положенні 1 або тільки в положенні 3 тригліцериду;
– схильність до гідролізу складноефірних зв’язків, утворених жирними кислотами з більш довгим або більш коротким ланцюгом, насиченими або ненасиченими; і в цілому залежність швидкості реакції від структури субстрату.
Позиційну специфічність можна визначити хроматографією в тонкому шарі силікагелю, насиченого борною кислотою, 1,2-дігліцериди відокремлюють від 1,3-дігліцеридів та 1- та 2-моногліцеридів.
Ці продукти можна оцінити кількісно безпосередньо газорідинною хроматографією після перетворення іх в похідні триметилкремнієвої кислоти. Можна також використовувати в якості субстрату змішані тригліцериди з відомим позиційним розподіленням жирних кислот. Після ліполізу продукти реакції відокремлюють та аналізують. Наприклад, тригліцериди, жирні кислоти та дігліцериди можна відокремити на колонці з кремнієвою кислотою при елююванні сумішшю гексан–діетиловий ефір [5].
Стереоспецифічність ліпази також можна перевірити, використовуючи субстрат з відомим стеричним розподіленням жирних кислот, котрий отримують або повним хімічним синтезом, або ацилуванням по третьому положенню 1,2-дігліцериду, отриманого із фосфоліпіду за допомогою фосфоліпази 3.
Мікробна ліпаза в комплексі з амілазою використовуються в якості лікувального препарату, що сприяє травленню. Такий препарат має бути активним в широкому діапазоні рН, щоб гідролізувати жири в шлунку та кишківнику.
Препарати, отримані із культуральної рідини Aspergillus oryzae, є комплексами з протеазою та амілазою, використовуються для фармацевтичної та косметичної промисловості.
Ліпаза А. awamori була використана для знежирювання та очищення грізеофульвіна, отриманого при культивуванні P. nigricans. Застосування ліпази дозволило підвищити вихід антибіотику та поліпшити його якість.
Не меншу цікавість має практичне використання ліпаз в харчовій та інших галузях промисловості.
Окрім того, ліпаза входить до складу багатьох синтетичних миючих засобів як активна біодомішка. Значний інтерес можуть представити ліпази для отримання різних жирних кислот із тригліцеридів у зв’язку з можливістю використання жирних кислот в якості антиканцерогенних препаратів.
При культивуванні дріжджів на середовищах з парафінами в клітинах та в середовищі накопичуються тригліцериди. Внесення в культуральну рідину ліпази дозволить значно підвищити вихід біомаси дріжджів за рахунок використання ними продуктів гідролізу.
Гідроліз дешевих тваринних жирів мікробними ліпазами перед омиленням жирних кислот може бути одним з методів отримання гліцерину[9].
Ліполітичні препарати можуть бути отримані з тваринних тканин, насіння деяких рослин та мікроорганізмів. Джерелом тваринної ліпази є підшлункова залоза. Серед бактерій активні продуценти ліпаз належать до родів Pseudomonas, Bacillus, Acinetobacter, Propionibacterium, Chromobacterium, Alcaligenes. Серед дріжджів найкращими продуцентами є представники роду Candida (C. lipolytica, C. paralipolytica, C. cylindraceae). Високою ліпазною активністю характеризуються мікроскопічні гриби родів Geotrichum, Aspergillus, Mucor, Rhizopus, Penicillium, Oospora, Humicola. Серед актиноміцетів продуцентами можуть бути представники видів Streptomyces flavogriseus, Thermoactinomyces vulgaris.
Бактерії, як правило, накопичують внутрішньоклітинну ліпазу, актиноміцети, гриби та дріжджі – переважно позаклітинну.
Джерелами вуглецю в середовищі для отримання ліпаз можуть бути крохмаль, декстрини, моно- та олігосахариди. До складу поживних середовищ часто вводять компоненти ліпідної природи, оскільки, на думку деяких дослідників, ліпази є індуцибельними ферментами. Однак, не кожен ліпідний компонент стимулює утворення ліпаз. Найчастіше в поживних середовищах використовують оливкову та бавовникову олію, рідше – соняшникову, рапсову, кукурудзяну, касторову, соєву олії. В залежності від потреб продуценту в середовищах використовують мінеральні, органічні та змішані джерела азоту. Важливим компонентом поживного середовища є соєва мука, ліпідний комплекс якої стимулює утворення ліпаз багатьма мікроорганізмами[10].
Отримання препаратів ліпаз і їх очищення здійснюється з фільтратів культуральних рідин. Біомаса продуценту та тверді домішки видаляють центрифугуванням або фільтруванням. Рідка фаза стабілізується додаванням солей і концентрується ультрафільтрацією або вакуум-вапарюванням. Отримай концентрат може бути висушений для отримання препаратів ліпази з індексом Г3х. Подальша очистка ферментів передбачає їхнє осадження органічними розчинниками або неорганічними солями. Ліпази досить чутливі до впливу органічних розчинників, під їх впливом часто спостерігається часткова денатурація білка, що призводить до порушення структури активного центру та втрати активності.
Тому для виділення ліпаз частіше використовують висолювання сульфатом амонію.
Для отримання високоочищених препаратів ліпази використовуються всі методи хроматографії, електрофорез, гель-фільтрація, ізофокусування.
Кривовой А.Ю. із співавторами розроблений для промислового використання спосіб виділення гомогенної ліпази із препарату Ліпоризин Г10х. Для очищення ферменту запропоновано використовувати метод метало-хелат-афіної хроматографії. Схема очищення наведена на рис. 13.3. Використовуючи такий метод вихідний препарат Ліпоризин Г10х було очищено у 44 рази.
Із підшлункової залози можна одержати багато різноманітних ферментів - трипсин, хімотрипсин, рибонуклеазу, дезоксирибонуклеазу, панкреатопептидазу, колагеназу і комплексний препарат панкреатин.
Панкреатин. Препарат містить ферменти підшлункової залози, головним чином трипсин, амілазу та в незначній кількості ліпазу. Сировиною для одержання панкреатину служить підшлункова залоза свиней та рогатої худоби [13].
У підшлунковій залозі протеолітичні ферменти утворюються у вигляді проферментів: трипсиногена, хімотрипсиногена. Активування цих ферментів відбувається після гідролізу фрагмента поліпептидного ланцюга, що маскує активний центр протеїназ. При одержанні панкреатину активування проферментів підшлункової залози здійснюється в екстракті в лужному середовищі у присутності іонів кальцію із затравкою (панкреатин).
Тканини підшлункової залози подрібнюють на вовчках і заливають водою, яка підкислена оцтовою крижаною кислотою (5 мл на 1 л води). Настоювання триває у реакторі з мішалкою 4 год при температурі 10°С. Екстракт відокремлюють центрифугуванням чи проціджуванням з наступним пресуванням залишку. Для активування проферментів в екстракті створюють середовище зі значенням рН 8,1; додають хлорид кальцію до концентрації 0,05 М і затравку – панкреатин. Настоюють 24 год. при температурі 5°С. Потім екстракт підкислюють до значення рН 6,0 і в ізоелектричній точці осаджують. Осад відокремлюють, знежирюють ацетоном і висушують у вакуум-сушильній шафі при температурі не вище 40°С. Подрібнюють у кульовому млині.
Обгрунтування цілей
На даний час на ринку ферментних препаратів затребувані ліполітичні ферменти . Користуючись даними дослідницької компанії Abercade, стан ринку ферментних препаратів можна охарактеризувати передусім їх за- стосуванням у таких галузях, як харчова промисловість та виробництво СМЗ, і досить динамічним розвитком у секторі ферментних препаратів для сільського господарства. Ферментні кормові домішки є однією з основних складових комплексу засобів, що можуть бути альтернативою кормовим антибіотикам.
Загальною тенденцією для України є те, що сучасні потреби промисловості у ферментних препаратах більш ніж на 90 % задо- вольняються за рахунок імпорту. На частку українських виробників припадає менше 10 %. При цьому впродовж останніх кількох років внутрішнє виробництво демонструє тенденцію до скорочення, що зумовлено значною конкуренцією з боку зарубіжних фірм, які пропонують широкий асортимент високоякісної продукції [15].
Отже, головними цілями та завданнями дипломного проекту є:
Створення потужної бази з вироблення ферментних препаратів на основі сучасного обладнання;
Насичення вітчизняного ринку продукцією на основі дешевої місцевої сировини;
Імпортозаміщення на ринку ферментних препаратів вітчизняними розробками;
Підвищення якості ферментних препаратів, задля створення стійкої конкуренції та задоволення попиту серед споживачів;
Конкретними цілями дипломного проекту є:
-Розробка технологічної схеми виробництва;
-Раціональне використання сировини;
Контроль якості продукції
РОЗДІЛ 2. ТЕХНОЛОГІЧНА ЧАСТИНА
2.1 Характеристика готового продукту
Ліполітичний ферментний препарат, отриманий за допомогою штаму Serratіamarcescens ИБ 2-2, володіє високої ліполітичною активністю, що може бути використаний як основу біопрепарату для біологічного очищення стічних вод або каналізаційних систем від жирів.
Препарат являє собою пористу масу або порошок ясно-коричневого кольору зі слабким специфічним запахом. Мало розчинний у воді.
Фермент випускається в герметично упакованих пакетиках із тришарової ламінованої фольги. На кожну пакувальну одиницю препарату нанесене маркування, що містить найменування, активність згортання, строк придатності, умови зберігання. [4]
Зберігання концентрату здійснюється при температурі від 2 до 8°С і відносної вологості повітря не більше 80%. Строк придатності, при вищевказаних умовах зберігання - не більше 1 року.
Максимальна специфічна активність ферменту штаму Serratіa marcescens ИБ 2-2 становить 1018 мкМ олеїнової кислоти/ мг біомаси.
2.2 Характеристика біологічного об’єкту та допоміжних речовин
Характеристика продуценту
Продуцентами ферменту для розщеплення жирів обрано
штамом Serratіamarcescens ИБ 2-2, виділеним зі зразка стічних вод, відібраного з аеротенку біологічних очисних споруджень Пермського м'ясокомбінату (рис 2.1).
Штам Serratіa marcescens ИБ 2-2 характеризується наступними ознаками:
1. Морфологічні ознаки. Клітини паличкоподібні, прямі, розміром 0,5-0,8×1,0-3,0 мкм, рухливі, одиночні, парні або в ланцюжках, спор не утворюють. Грамнегативні. На мясопептонном агарі (МПА)колонії - круглі з рівними краями, гладкі, злегка опуклі, непрозорі, блискучі, кремові, м'якої консистенції колонії, діаметр 3-5 мм.[19]

Рисунок2.1 – Бактерії Serratіa marcescens ИБ 2-2 [17]
2. Фізіологічні та біохімічні ознаки. Штам є факультативним анаеробом, має дихальний і бродильний тип метаболізму, не вимогливий до факторів росту. Оптимальна температура росту 28-30°С, ростуть при 5°С и 40°С. Розріджує желатин, пептонізує і згортає молоко, гідролізує лецитин.
Здатний рости на середовищі Симмонса із цитратом, реакція Фогеса-Проскауера позитивна. Проба з метиловим червоним позитивна. Дає негативний оксидазний, позитивний каталазний тести. Ферментує з утворенням кислоти глюкозу, ксилозу, арабінозу, сахарозу, маннозу, галактозу, фруктозу, лактозу, мальтозу, крохмаль, сорбітол, ацетат. Росте на МПА з 8% NaCl.
Штам зберігається на косяках МПА в холодильнику з пересіванням на свіжі косяки через 2-4 місяця, а також у ліофильно-высушенному стані.
Характеристика допоміжних речовин
Для культивування штаму Serratіa marcescens ИБ 2-2 з метою одержання ліпази застосовують поживне середовище наступного складу, г/л:
соєве борошно - 5;
дріжджовий екстракт - 60;
К2НРО4 - 5,0;
(NH4)2SO4 - 1,0.
Соєве борошно має легкий горіховий запах, колір від жовтого до кремового, не має бобового присмаку й має високі технологічні й функціональні властивості. Зміст жиру в її складі не менш 17 %, сирого білка (протеїну) не менш 38 %, сирої клітковини 3,5 %. Борошно містить велику кількість вітамінів (А, групи В, РР й Е), мінеральні речовини (магній, кальцій, йод, мідь, фтор, залізо). Характеристики соєвого борошна наведені в таблиці 2.1.
Таблиця 2.1 – Вимоги, які пред’являються до соєвого борошна
| Показник | Характеристика |
| Зовнішній вигляд | Суха, однорідна сипуча маса |
| Колір | Світло-кремовий |
| Смак та запах | М’які, характерні для даного виду муки, без сторонніх присмаків та запахів |
| Хімічний склад,% - білок (на суху основу) - вологість - жиромасла - клітковина (волокна) - зола - вуглеводи | 54 8 1,5 3,5 – 4,5 6 – 7 Із різниці |
Дріжджовий екстракт являє собою розчинний вміст дріжджових клітин. Він містить багато вітамінів групи В и має тому високу фізіологічну поживну цінність. Дріжджовий екстракт повинен відповідати вимогам наведеним у таблиці 2.2.
Таблиця 2.2 - Вимоги, які пред’являються до дріждового екстракту
| Показник | Характеристика |
| Колір | світлий |
| Прозорість | висока |
| Розчинність | добра |
| Вологість, %, не більше | 6 |
| рН (2% водний розчин) | 5,3-7,2 |
| Загальна кількість мікроорганізмів на чашках Петрі, мкг/г | 10000 |
| Загальна кількість азоту, % | 10 |
К2НРО4 - використають для приготування буферних розчинів, як поживне середовище для вирощування цвілевих грибів та бактерій, які продукують ферменти, пеніциліни Розчинний у воді.[8]
Сульфат амонію синтетичний (сірчано-кислий амоній) (NH4)2SO4- азотно-сірчане мінеральне ГОСТ-9027-82. Сульфат амонію містить 21% азоту й 24% сірки. Це хімічно нейтральна кристалічна сіль білого кольору, добре розчинна у воді. Гігроскопічність її слабка, тому при тривалому зберіганні не злежується й зберігає сипкість [17].
2.3. Блок-схема виробництва
Схема виробництва ферменту представлена на рис. 2.2 та на плакаті №2 графічної частини.
Процесуальна схема складається з наступних стадій: технологічний процес (ТП), допоміжні роботи (ДР), знешкодження відходів (ЗВ), переробка відходів (ПВ), пакування, маркування, відвантаження (ПМВ).
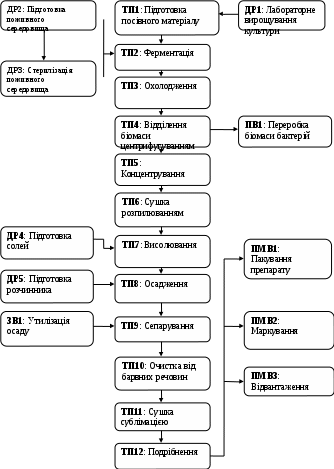
Рисунок 2.2 Блок-схема виробництва
2.4 Опис біотехнологічного процесу
ТП3 – Охолодження культуральної рідини
Готова культуральна рідина при перемішуванні подається у теплообмінник для охолодження. Необхідність охолодження зв’язана з тим, що відразу усю культуральну рідину переробити неможливо, а при тривалому зберіганні у збірнику може відбутися інактивація ферменту.
ТП4 – Відділення біомаси центрифугуванням
Очищення напівпродукту від сторонньої мікрофлори в процесі відділення неактивних домішок відбувається шляхом центрифугуванням попередньо обробленої СаСl2 ферментної витяжки. Додавання солей двовалентних металів у витяжку перед центрифугуванням сприяє утворенню внутрішньомолекулярних зв'язків й агрегації білкових молекул, збільшуючи в'язкість розчину. Розгалужені агрегати утворяться при взаємодії солей кальцію, з білковими молекулами. Обробка витяжок хлористим кальцієм у кількості 1 % з наступним центрифугированием підвищує ефективність очищення до 98-99%.
ТП5 – Концентрування культуральної рідини
Ферменти дуже чутливі до температури випарювання, тому основною умовою концентрування ферментних розчинів є короткочасне ведення процесу при низьких температурах кипіння, щоб рідина яка випарювалась не перегрілась, а ферменти не інактивувались. На цій стадії відбувається упарювання рідини у 5 разів, режими наступні: температура теплоносія 90 – 100 °С, температура кипіння 35 – 40 °С. При цьому втрати активності не перевищують 10 %.
ТП6 – Сушка
На цій стадії відбувається висушування препарату за допомогою розпилюючої сушарки. Ця сушка дозволяє доволі швидко оброблювати великі маси ферментних розчинів та отримувати одразу подрібнений сухий препарат. Тривалість перебування препарату в сушильній вежі 5-8 с. При взаємодії маси з теплоносієм волога миттєво випарюється, частки охолоджуються та не дивлячись на досить високі температури теплоносія на вході та виході, репарат не нагрівається вище 35 – 40 °С. Втрати активності порівняно малі (7 – 10 %).
ТП7 – Висолювання
Висалювання застосовується для фракціонування білків й у тому числі ферментів. Це досягається шляхом періодичного підвищення концентрації солі в розчині й відповідно періодичного відділення осадів, що утворяться. Найбільше часто висолюючим засобом служить сульфат амонію (NH4)2SO4. При висалюванні ферментів з 3%-вої культуральної рідини на одну вагову частину препарату витрачається майже 90 частин солі. Для зменшення витрати сірчанокислого амонію доцільно проводити висалювання з більше концентрованих ферментних розчинів, попередньо упарених на вакуум-випарних апаратах.
ТП8 – Осадження
Осадження відбувається під дією розчинника. В якості розчинника використовують етиловий або ізопропіловий спирт. Етиловий спирт повністю осаджує ферменти при додаванні 4 обсягів на 1 обсяг концентрованої до 10-12% сухих речовин культуральной рідини. Ізопропіловий спирт повністю осаджує ферменти при співвідношенні 2:1.
ТП9 – Сепарування
Осад, який утворився на стадії осадження відділяється від робочого розчину за допомогою сепарування. Автолізати, що направляють на сушіння, необхідно попередньо концентрувати. Поділ на центрифугат й осад дозволяє сконцентрувати основну масу бактеріальних клітин і ферментів у білковій частині осаду, скоротити обсяг розчину приблизно в 5 разів і прискорити процес сушіння в 2 рази, що в цілому скорочує цикл готування біопрепаратів в 10 разів.
ТП10 – Очистка від барвних речовин
Очистка ферментних розчинів від барвних речовин може бути здійснена шляхом пропускання розчину через шар активованого вугілля.
ТП11 – Сушка
Сушіння осаду автолізату без попереднього заморожування більше раціональні у зв'язку з економією часу й енергії. Температура поверхонь, що гріють, електронагрівників може бути доведена до +60 °С. У кінцевий період сублімації (при випарі 60% вологи), коли температура продукту підвищується й близька до нуля, необхідно знизити температуру електронагрівників до 40-45°С щоб уникнути перегріву препарату і його передчасного відтавання.
Близько 60% часу біопрепарат перебуває в замороженому стані, а близько 40% - період досушки. Товщина шару матеріалу, що висушує, на протвенях повинна бути 10 мм. У період самозаморожування із препарату виддаляється 16-17% вологи, у період сублімації 65-67 й у період досушки 15-16%.
Оптимальний температурний режим роботи сублімаційної сушарки при сушінні осаду: температура сублімації не нижче мінус 15-20°С, температура досушки не вище 40°С.
ТП12 – Подрібнення
На цій стадії препарат подрібнюють на дробарках до надання йому товарного вигляду.
Допоміжні роботи:
ДР1 – Лабораторне вирощування культури
Бактеріальний штам Serratіa marcescens ИБ 2-2 зберігається на косяках МПА в холодильнику з пересіванням на свіжі косяки через 2-4 місяця. Процес розмноження починається після перенесення вмісту пробірки на свіже поживне середовище у пробірки. Із пробірок культуру змивають стерильною водою та у вигляді суспензії використовують для засіву колб. Колби закріплюють на качалці, яка струшує рідину у колбах і сприяють розчиненню кисню в середовищі, що забезпечує нормальні умови життєдіяльності мікроорганізмів.
ДР2 – Підготовка поживного середовища
На цій стадії відбувається змішування всіх компонентів поживного середовища. Воно має наступний склад, г/л: соєве борошно - 5; дріжджовий екстракт - 60; К2НРО4 - 5,0; (NH4)2SO4 - 1,0.
ДР3 - Стерилізація поживного середовища
Підготовлене середовище подається до системи безперервної стерилізації, а потім подається в спіральний теплообмінник для витримки. Після цього середовище охолоджується та направляється у ферментатор.
ДР4 – Підготовка солей
На цій стадії проводиться підготовка солей, які приймають участь у висолюванні. Висолюючим засобом служить сульфат амонію (NH4)2SO4.
ДР5 – Підготовка розчинника.
На цій стадії проводиться підготовка розчинників. В якості розчинника виступає етиловий спирт, рідше ізопропіловий.
Переробка відходів:
ПВ1 – Переробка біомаси бактерій.
На цій стадії біомаса бактерій, яка була виділена за допомогою центрифугування, піддається термічній обробці і направляється на тваринницькі ферми, в якості корму для тварин.
ПВ2 – Очистка повітря
Повітря, за допомогою якого проводилось сушіння, може містити часточки продукту. Для запобігання потрапляння часток у приміщення цеху, його направляють на очистку в циклон.
Знешкодження відходів:
ЗВ1 – Утилізація осаду
Осад після сепарування направляють на утилізацію
Стадія пакування, маркування, відвантаження:
ПМВ1- Пакування препарату
Сухий препарат упаковують в мішки або крафт-пакети по 25-40 кг. Останньому виду впакування варто віддати перевагу, тому що він краще охороняє препарат від зовнішніх впливів, що збільшує строки його зберігання без зниження ферментативної активності. Заповнені мішки зашивають або заклеюють. Розфасовка ведеться вручну. Приміщення, у якому проводиться розфасовка й упакування, повинне бути забезпечене приточно-витяжною вентиляцією. Операції виконуються із застосуванням засобів індивідуального захисту: окулярів, респіраторів, рукавичок.
ПМВ2 – Маркування
На мішок наклеюють етикетку із вказівкою назви продукту, завода-виробника, дати випуску, номера партій, ваги нетто й брутто й показника ферментативної активності.
ПМВ3 - Відвантаження
Готовий запакований препарат відвантажується у складське приміщення, звідкіля направляється покупцю.
2.5 Норми біотехнологічного процесу
В процесі культивування мікроорганізму – продуценту, фермент накопичується у культуральній рідині. Ріст мікроорганізмів відбувається в періодичній культурі.
При внесенні у поживне середовище продуцент росте до тих пір, доки вміст якого-небудь необхідного компонента не стане мінімальним або не вичерпається, після чого ріст припиняється. Якщо впродовж усього цього часу в середовище не вносити ніяких поживних речовин і не виводити продукти метаболізму, то одержимо так звану періодичну культуру (популяцію клітин в обмеженому життєвому просторі).[16]
Крива, що описує залежність логарифму кількості живих клітин від тривалості культивування, називається кривою росту (рис. 2.3). Така крива має S-подібну форму, на ній можна виділити кілька фаз росту: лаг-фазу, експоненційну (логарифмічну), сповільненого росту, стаціонарну, відмирання та виживання [3].

Фази росту: І — лаг-фаза; ІІ— експоненційна; ІІІ — сповільненого росту; IV — стаціонарна; V — відмирання; VI — виживання
Рисунок 2.3 - Крива росту популяції
Лаг-фаза. Починається з моменту посіву культури у свіже поживне середовище. У цей період клітини адаптуються до даних умов культивування.
Тривалість лаг фази залежить від передісторії інокуляту та його віку, а також від того, наскільки придатним для росту є дане середовище і умови культивування (рН, температура, концентрація розчиненого кисню). Наприклад, якщо джерела вуглецю та енергії в новому середовищі відрізняються від тих, які були в середовищі при одержанні посівного матеріалу, то адаптація до нових умов передбачає синтез нових ферментів, які раніше були непотрібні і тому не синтезувались. Утворення нових ферментів індукується новим субстратом.
Прикладом впливу субстрату на синтез ферментів є диауксія. Це явище послідовного використання двох субстратів, або явище двофазного росту Кількісні зміни складу бактеріальної клітини під час лаг-фази стосуються змін РНК: її вміст збільшується у 8—12 разів. Це вказує на участь РНК і рибосом у синтезі ферментних білків.
Експоненційна фаза. Ця фаза характеризується максимальною швидкістю поділу клітин. У цій фазі процеси росту проходять збалансовано (тобто подвоєння біомаси супроводжується подвоєнням кількості білка, ДНК, РНК та ін.). Можна сказати, що культура в експоненційній фазі складається із "стандартних" клітин. Але треба мати на увазі, що і в експоненційній фазі клітини періодичної культури зазнають змін, оскільки постійно змінюється середовище: зменшується концентрація субстрату, збільшується густина клітинної суспензії, накопичуються продукти обміну. У зв'язку з тим що в цій фазі швидкість поділу відносно постійна, вона найзручніша для визначення швидкості поділу та швидкості росту. Вплив факторів зовнішнього середовища, складу поживного середовища на ріст мікроорганізмів визначають, спостерігаючи за показником біомаси чи кількістю клітин саме під час експоненційного росту.
Фаза сповільненого росту. Настання цієї фази зумовлене якісними змінами поживного середовища (споживання поживних речовин, накопичення продуктів метаболізму, дефіцит кисню, зміна рН). Клітина реагує на це зміною інтенсивності синтезу РНК, білка, полісахаридів та інших компонентів.
Стаціонарна фаза. Вона настає тоді, коли кількість клітин перестає збільшуватись, тобто характеризується рівновагою між клітинами, що утворюються, та клітинами, що гинуть. У стаціонарній фазі спостерігається максимальна біомаса і максимальна сумарна кількість клітин.
Фаза відмирання. Характеризується зниженням кількості живих клітин, підвищенням гетерогенності популяції. Іноді клітини лізуються під дією своїх власних ферментів (автоліз). [12]
Фаза виживання. Характеризується наявністю окремих життєздатних клітин в умовах загибелі більшості клітин популяції. Якщо такі клітини пересіяти в свіже поживне середовище, вони починають активно рости та ділитися. Такі виживші клітини характеризуються низькою інтенсивністю процесів метаболізму.
Так як фермент накопичується у культуральній рідині і є показником метаболічної активності, то для найбільшого його виходу необхідно проводити культивування продуценту до переходу культури у стаціонарну фазу.
На метаболізм продуценту впливають умови зовнішнього середовища, рівень поживних речовин, їхня збалансованість, відвід метаболітів, зміна активної кислотності середовища, температури, насиченість середовища розчиненим киснем, стан і вік культури продуцента та багато інших факторів. Залежно від способу культивування і фізіологічних особливостей продуцента значимість цих факторів і ступінь їх впливу на процес біосинтезу різні, однак деякі загальні закономірності можна виділити.
Тривалість культивування. Швидкість росту окремих штамів неоднакова. Оптимальна тривалість культивування, що забезпечує максимальну продуктивність, установлюється експериментально [4]. Вона залежить від дуже багатьох факторів: складу середовища й способу її подачі
при культивуванні, ступеня аерації середовища, від того, чи є біологічно-активна речовина позаклітинним або внутрішньоклітинним продуктом, від роду продуцента і ін. У деяких випадках додаткове введення середовища (підживлення) у початковій стадії росту дозволяє на 30-40 % скоротити тривалість культивування й значно підвищити продуктивність мікроорганізмів. Тривалість культивування найчастіше залежить від фізіологічних особливостей обраного продуцента. Тому прогнозувати оптимальну тривалість вирощування дуже складно й потрібно її експериментальне визначення.
Величина рН середовища. Вплив рН середовища при глибинному культивуванні мікроорганізмів величезне, причому велике значення має не тільки його вихідна величина, але й зміна його при стерилізації й у результаті споживання катіонів або аніонів середовища в процесі життєдіяльності мікроорганізмів. У результаті такого споживання відбувається або підлужування, або підкислення культуральної рідини. Оптимальне вихідне значення рН середовища залежить від особливостей продуцента, але можна виділити загальні закономірності. Гриби й дріжджеподібні організми добре ростуть в середовищах із рН від 3,8 до 5,6. Бактерії найкраще розвиваються при рН, близькому до нейтрального (6,2-7,4). Залежно від складу середовища і продуктів метаболізму рН середовища може зрушуватися як у кислу, так й у лужну зону.
Температура культивації.Більшість мікроорганізмів-продуцентів являються мезофілами, оптимальна температура для їх розвитку – 22-32ºC. Серед бактеріальних продуцентів часто зустрічаються термофільні мікроорганізми, для яких оптимальна температура культивування становить 35—55 ºС. Термофільні мікроорганізми становлять особливий інтерес для промислового використання, тому що культивування при високих температурах створює селективні умови для їхнього розвитку й дозволяє знизити вимоги до стерильності процесу. Крім того, термофільні мікроорганізми синтезують ферменти, що володіють підвищеною термостійкістю.
2.6 Матеріальний баланс
Вихідні данні (%):
кількість посівного матеріалу, ………………………………. 5,0
склад поживного середовища
соєве борошно ………………………………..……………….. 0,42
дріжджовий екстракт ………………………………………….. 5,0
К2НРО4 ……………………………………………………..…… 0,42
(NH4)2SO4………………………………………………...……… 0,083
1. Розраховуємо необхідну кількість посівного матеріалу по формулі:
 кг
кгМаса культуральної рідини визначається по формулі:
 .
.2. Визначимо кількість поживного середовища:
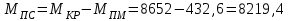 кг
кг3. Розрахуємо кількість інгредієнтів по формулі:
 .
. кг ;
кг ;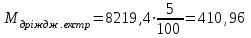 кг;
кг;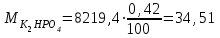 кг;
кг; кг;
кг;Отримані дані зводимо у таблицю 3.3.
Таблиця 3.3– Матеріальний баланс виробництва
| Початок ферментації | Кінець ферментації | |||||
| Назва | кг | % | Назва | кг | % | |
| Посівний матеріал | 432,6 | 5 | Фермент | 18,75 | 0,2 | |
| Соєве борошно | 34,51 | 0,42 | Баластні речовини | 8633,25 | 99,8 | |
| Дріжджовий екстракт | 410,96 | 5 | | |||
| К2НРО4 | 34,51 | 0,42 | ||||
| (NH4)2SO4 | 6,82 | 0,083 | ||||
| Вода | 7732,6 | 94,077 | ||||
| Разом | 8652 | 100 | Разом | 9072 | 100 | |
2.7 Матеріальні розрахунки
2.7.1 Розрахунок основного обладнання
Вхідні дані:
Продуктивність виробництва,
 ;
;Початкова концентрація препарату,
 ;
;Кінцева концентрація препарату,
 ;
;Один виробничий цикл,
 ;
;Робочих днів,
 .
.Добова продуктивність

 ;
;
Кількість циклів за добу
 ;
;
Кількість продукції за один виробничий цикл
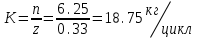
Обчислюємо необхідну кількість культуральної рідини.

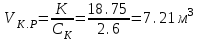
З урахуванням коефіцієнту заповнення об’єму апарату

Кз=0,75;
 ;
;Приймаємо для подальшого розрахунку стандартизований ферментер об’ємом 10 м3.
Уточнюємо коефіцієнт заповнення:
 .
.Знаходимо діаметр та висоту ферментатора по формулі:
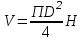 , тоді
, тоді 
Для розрахунку приймаємо діаметр апарату D = 1,7 м, тоді визначаємо висоту ферментатора:
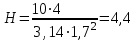 м.
м.1 2 3