
Ім'я файлу: Техноекологія контрольна.docx
Розширення: docx
Розмір: 93кб.
Дата: 12.05.2020
скачати
Пов'язані файли:
Test.docx
Розширення: docx
Розмір: 93кб.
Дата: 12.05.2020
скачати
Пов'язані файли:
Test.docx
Задача №1.
Яка може бути концентрація оксиду вуглецю (CO) у повітрі промислового регіону, якщо концентрація сірчистого ангідриду (SO2) складає (0,02+0,1n) мг/м3, а концентрація сірководню (H2S) – (0,001+0,001n) мг/м3, щоб суміш була безпечною.
Рішення задачі:
n=1
C(SO2) = 0,02+0,1n = 0,12 мг/м3
C(H2S) = 0,001+0,001n = 0,002 мг/м3
Безрозмірна концентрація q шкідливих речовин у повітрі не повинна перевищувати одиниці. По таблиці 1 знаходимо середньодобові ГДК для сірчистого ангідриду (SO2) та сірководню (H2S).
ГДКс(SO2) = 0,15 мг/м3
ГДКс(H2S) = 0,008 мг/м3
Визначаємо безрозмірну концентрацію сірчистого ангідриду (SO2) та сірководню (H2S) за формулою 1:
q =
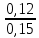 +
+  = 1,05
= 1,05Отримана величина перевищує одиницю. Отже, така середньодобова концентрація суміші сірчистого ангідриду (SO2) та сірководню (H2S) в повітрі промислового регіону є небезпечною навіть без присутності оксиду вуглецю (CO).
По таблиці 1 знаходимо максимально разові ГДК для оксиду вуглецю (CO), сірчистого ангідриду (SO2) та сірководню (H2S).
ГДКр(CO) = 3 мг/м3
ГДКр(SO2) = 0,5 мг/м3
ГДКр(H2S) = 0,008 мг/м3
За формулою 3 визначаємо питому концентрацію оксиду вуглецю:
C(CO) = [1 – (
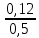 +
+  )]*3 = 1,53 мг/м3
)]*3 = 1,53 мг/м3Таким чином, враховуючи максимально разові ГДК, повітря промислового регіону може містити 1,53 мг/м3 оксиду вуглецю (CO), щоб суміш була безпечною.
Задача №2.
У рибогосподарську водойму надходить стічна вода, в 1 кг якої міститься (0,02+0,01n) мг миш’яку, (0,07+0,01n) мг свинцю і (0,0007+0,0001n) мг фенолу.
Чи необхідно розбавляти дану стічну воду чистою і, якщо потрібно, то в якій кількості?
Рішення задачі:
n=1
У рибогосподарську водойму надходить стічна вода, в 1 кг якої міститься 0,03 мг миш'яку, 0,08 мг свинцю і 0,0008 мг фенолу.
Визначаємо безрозмірну концентрацію по формулі (1). По таблиці 2 знаходимо ГДК для миш'яку (ГДК1=0,05), свинцю (ГДК2=0,1), фенолу (ГДК3=0,001).
Таким чином,
q =
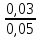 +
+ 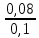 +
+ 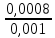 = 2,2
= 2,2Отримана величина перевищує одиницю. Необхідно стічну воду розбавити.
У даному випадку маса розчинника складає 1,2 кг.
Задача №3.
Визначити щільність газу для наступних умов.
Склад сухої частини газу, у %: СО2=10; СО=4; N2=80; О2=6.
Барометричний тиск, мм рт.ст.: 720+n. Температура газів, °С: t=90+5n.
Газ знаходиться під розрідженням, мм вод.ст.: ΔР=20+2n
f=(15+n), г/м3 норм. сухі гази.
Рішення задачі:
n=1
Барометричний тиск p = 721 мм. рт. ст.
Абсолютний тиск pa = p + Δp = 743 мм. рт. ст.
tгазів = 95 °С
f=16 г/м3 = 0,016 кг/м3
Відносна молярна маса компонентів газу:
μCO2 = 44; μCO = 28; μN2 = 28; μO2 = 32.
Обчислимо удавану молярну масу суміші:
μсум =
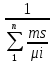
μсум =
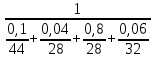 =
= 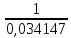 = 29,285 кг
= 29,285 кгЩільність при нормальних умовах:
ρ0 =
 =
= 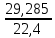 = 1,307 кг/м3,
= 1,307 кг/м3,де Vm – молярний об’єм газової суміші за нормальних умов.
Щільність газової суміші при заданих умовах знаходимо згідно виразу:
ρсум = ρ0*
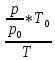
ρсум = 1,307*
 = 0,948 кг/м3
= 0,948 кг/м3Визначимо щільність вологого газу при робочих умовах за формулою 13:
ρ =
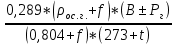
ρ =
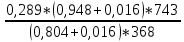 = 0,686 кг/м3
= 0,686 кг/м3Задача №4.
Визначити щільність газу, суха частина якого така ж, як і в попередній задачі. У газоході розрідження 34 мм вод.ст. Температура газу t=125 °С. Вологість газу (у порівнянні з попередньою задачею) задана по іншому: відома крапка роси, °С: tp=20+n.
Рішення задачі:
Відносна молярна маса компонентів газу:
μCO2 = 44; μCO = 28; μN2 = 28; μO2 = 32.
Удавана молярна маса суміші:
μсум =
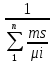
μсум =
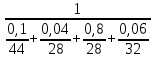 =
= 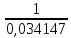 = 29,285 кг
= 29,285 кгЩільність при нормальних умовах:
ρ0 =
 =
= 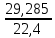 = 1,307 кг/м3,
= 1,307 кг/м3,де Vm – молярний об’єм газової суміші за нормальних умов.
Оскільки хімічний склад газу схожий за складом з повітрям, розв’яжемо задачу, використовуючи H, d-діаграму вологого повітря (рис.1).
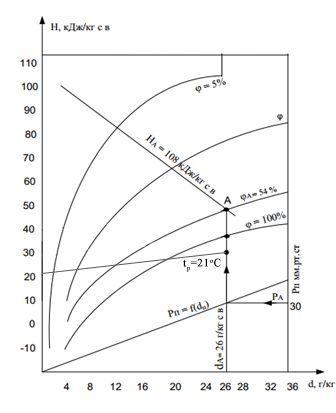
Рис.1. Визначення параметрів вологого повітря по H,d–діаграмі
Значення температури точки роси визначається по ізотермі при перетині вертикалі, опущеної з точки А на лінію φ = 100%.
tp= 29 °С
З діаграми отримуємо вологовміст в розрахунку на 1 кг сухого повітря
d = 26 г/кг с.пов.
Визначимо вологість в кг/м3:
1,307 кг суміші – 1 м3
1 кг - 0,765 м3
f=26г/0,765м3 = 0,034 кг/м3
Абсолютний тиск pa = p-Δp=760-34=726 мм. рт. ст.
Щільність газової суміші при заданих умовах знаходимо згідно виразу:
ρсум = ρ0*
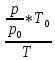
ρсум = 1,307*
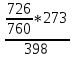 = 0,856 кг/м3
= 0,856 кг/м3Визначимо щільність вологого газу при робочих умовах за формулою 13:
ρ =
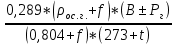
ρ =
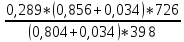 = 0,56 кг/м3
= 0,56 кг/м3Задача №5.
Визначити необхідну висоту димової труби, щоб вона створювала розрідження, Па: Р=200+10n. Температура газів у трубі, °С: t=300+10n. Температура повітря, °С: t=15+1/2n, щільність при нормальних умовах: ρ0(димових газів)=1,27г/м3; ρ0(для повітря)=1,29г/м3
Рішення задачі:
Визначимо щільність димових газів при заданих умовах:
ρдим.г = ρ0*
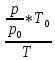
ρдим.г = 1,27*
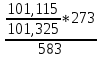 = 0,593 г/м3
= 0,593 г/м3Визначимо щільність для повітря при заданих умовах:
ρпов = 1,29*
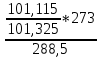 = 1,218 г/м3
= 1,218 г/м3Рівняння Бернуллі для потоку газу між входом в газохід і виходом із труби:
pбар1 + pгw2/2 - pбар2 + pw2/2 + pгgH = Δpвтр,
де pбар1 і pбар2 – барометричні тиски на горизонті газоходу і на виході із труби; w – швидкість газу, однакова в газоході та трубі; Δpвтр – сумарні втрати тиску.
Підстановка pбар1 в рівняння Бернуллі і скорочення дають:
Δpвтр = (ρпов - ρдим.г)gH
H =
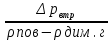 =
= 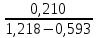 = 0,336 м
= 0,336 м