
Ім'я файлу: Арсен.doc
Розширення: doc
Розмір: 107кб.
Дата: 05.02.2020
скачати
Пов'язані файли:
ЗВІТ_Скрипюк.doc
geodynamika16201404.pdf
Зміни в Технічному регламенті законодавчо регульованих засобів в
Структура та метрологiчнi характеристики iнформацiйно-вимiрюваль
Структура та метрологiчнi характеристики iнформацiйно-вимiрюваль
Розрахунок глушників.doc
Лабораторна 1 (1).docx
Розширення: doc
Розмір: 107кб.
Дата: 05.02.2020
скачати
Пов'язані файли:
ЗВІТ_Скрипюк.doc
geodynamika16201404.pdf
Зміни в Технічному регламенті законодавчо регульованих засобів в
Структура та метрологiчнi характеристики iнформацiйно-вимiрюваль
Структура та метрологiчнi характеристики iнформацiйно-вимiрюваль
Розрахунок глушників.doc
Лабораторна 1 (1).docx
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Реферат на тему:
Арсен (As)
Виконала:
студентка групи: 31а
Перевірив:
Івано-Франківськ
2016р.
ЗМІСТ
ВСТУП . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
1НАЗВА ЕЛЕМЕНТА. ПОХОДЖЕННЯ НАЗВИ
ОТРИМАННЯ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
ПОШИРЕННЯ В ПРИРОДІ. ЗАГАЛЬНА
ХАРАКТЕРИСТИКА ПРОСТОЇ РЕЧОВИНИ . . . . . . . . . 6
3 ХІМІЧНІ ВЛАСТИВОСТІ ОКСИДІВ . . . . . . . . . . . . . . . . 7
4 ЗНАЧЕННЯ ХІМІЧНОГО ЕЛЕМЕНТА
В МЕДИЦИНІ ТА ТЕХНІЦІ . . . . . . . . . . . . . . . . . . . . . . . . . 13
ПЕРЕЛІК ПОСИЛАНЬ НА ДЖЕРЕЛА . . . . . . . . . . . . . . . . . . 14
ВСТУП
Перший контакт людини з арсеном відбувся ще у 3 тис. до нашої ери. У волоссі знайденої мумії (Отці — нім. Ötzi) в альпійському льдовику виявлений значний вміст арсену. З цього можна зробити висновок, що він працював на виробництві міді, руди якої часто забруднені арсеном.
Алхімічний символ Арсену.
У середні віки арсен відомий у вигляді аурипігменту (As2S3) та реальгару (As4S4) які були описані ще в часи Арістотеля. З ІІІ століття нашої ери (Ляйденський папірус) відомі ці сполуки у використанні для забарвлення срібла в золотий, а міді в білий кольори. Алхіміки у середньовічній роботі «Фізика і містика» припускали спорідненість сірки і ртуті. Арсен (ІІІ)-сульфід використовувався як фарба для малювання, засіб для усування волося на тілі а також проти легеневих хвороб.
В середні віки також Арсен (ІІІ)-оксид було знайдено в димі плавильних печей. Альбетрус Маґнус описав вперше добування арсену відновленням його вугіллям у 1250 році. Його вважають відкривачем арсену. Парацельс у XVI столітті ввів елемент до переліку лікувальних засобів.
1НАЗВА ЕЛЕМЕНТА. ПОХОДЖЕННЯ НАЗВИ. ОТРИМАННЯ
Арсен (As) — хімічний елемент з атомним номером 33, простою речовиною якого є напівметал арсен (миш'як). За звичайних умов найстійкіший металічний або сірий арсен — сірі кристали, крихкі. Реагує з киснем. Сплавляється з деякими металами, утворюючи арсеніди. Сполуки арсену дуже отруйні.
Застаріла назва: миш'як (мишак, аршеник, аршинник).
Назва миш'яку пов'язують з вживанням його сполук для знищення мишей та щурів. Виводять грецьке arsenikon — грец.αρσενικόν від перського زرنيخ (царник) — «золотистий». За іншою версією назву виводять від грецького «арсен» — сильний, потужний. Символ «As» запропонований у 1814 році Йонсом Якобом Берцеліусом.
Відомо понад 120 мінералів, що містять Арсен. Найпоширеніші: реальгар, аурипігмент, арсенопірит — основні руди арсену знаходяться в гідротермальних жилах разом з арсенистими і стибіїстими мінералами Ni, Co, Ag, Pb. Порівняно рідкісний.
Відкриття способу отримання так званого металевого арсену («сірого миш'яку») приписують знаменитому середньовічному алхіміку Альберту Великому, що жив у XIII ст. Однак набагато раніше грецькі та арабські алхіміки вміли отримувати арсен у вільному вигляді, нагріваючи «білий арсен» (те, що це триоксид арсену, а не проста речовина, було виявлено лише в 1789 р. А. Л. Лавуазьє, який і присвоїв елементу назву «арсенікум») з різними органічними речовинами. Існує безліч способів одержання арсену: сублімацією природного арсену, способом термічного розкладання арсенового колчедану, відновленням арсеновмісного ангідриду та ін. Сьогодні для отримання металевого арсену найчастіше нагрівають арсенопірит у муфельних печах без доступу повітря. При цьому вивільняється арсен, пари якого конденсуються і перетворюються на твердий арсен в залізних трубках, що виступають з печей, і знаходяться в особливих керамісних приймачах. Залишок в печах потім нагрівають при доступі повітря, і тоді арсен перетворюється на As2O3. Металевий арсен виробляють в досить незначних кількостях, і головна частина арсенвмісних руд переробляють на білий арсен, тобто в триоксид арсену — арсенистий ангідрид As2О3. Ще добувають арсен нагріванням без доступу повітря з арсенопіриту:
FeAsS(тв) → FeS(тв)+As(г)
Арсенопірит розкладається при нагріванні на сульфід заліза і елементарний арсен (з сублімацією As на холодному місті).
Арсен для напівпровідників добувають відновленням воднем із дистильованого AsCl3.
2AsCl3 + 3H2 → 6HCl + 2As
Арсенхлорид реагує з воднем утворюючи хлороводень та елементарний арсен.
2 ПОШИРЕННЯ В ПРИРОДІ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ПРОСТОЇ РЕЧОВИНИ
Хімічний символ Арсену – Аs.
Це лементи VА групи. На зовнішньому енергетичному рівні 5ē: 4s24p3.
Атомний радіус більший ніж у Нітрогену і Фосфору, тому він має менше значення електронегативності і менші окислювальні властивості. В Арсену більше виражені металічні властивості, ніж у Нітрогену і Фосфору. У сполуках проявляє ступні окислення: +5, +3, -3.
В природі зустрічається в сполуках з металами або сіркою:
Аs2S3 – ауріпігмент;
Аs4S4 – реальгар;
Fe AsS – миш’яковий колчедан.
Вміст з земній корі становить 5.10-4 % (мас.).
Одержують при нагріванні миш’якового колчедану без доступу повітря:
Fe As S → FeS+Аs↑
Або із ауріпігменту:
2Аs2S3 + 902 = → 6SO2 + 2Аs2O3
Аs2O3 + 3C = 3CO + 2As
Алотропічні модифікації
Подібно до фосфору Арсен (миш’як) існує в кількох алотропічних видозмінах. Найстійкіший за звичайних умов і при нагріванні металічний, або сірий миш’як.
Сірий (металічний) миш’як – сріблясто-сіра кристалічна речовина з металічним блиском (ρ = 5.72 г/см2). Не розчиняється у воді і органічних розчинниках. При нагріванні він сублімується. Він електропровідний.
Жовтий миш’як – жовта кристалічна речовина, яка легко окислюється і переходить в сірий миш’як.
Чорний миш’як – аморфна речовина, яка при слабкому нагріванні переходить в сірий миш’як.
3 ХІМІЧНІ ВЛАСТИВОСТІ ОКСИДІВ
Серед складних неорганічних речовин виділяють оксиди, гідроксиди, кислоти, солі та комплексні сполуки.
Оксиди – складні речовини, що складаються з двох елементів, один з яких Оксиген у ступені окиснення –2. В оксидах не існує зв’язку між атомами Оксигену. Сполуки, у яких є такий зв’язок, називають пероксидами, ступінь окиснення Оксигену у них –1, їх відносять до класу солей гідроген пероксиду Н2О2 (табл. 13.5).
Хімічну (систематичну назву) оксидів складають з двох слів: перше – назва елемента у називному відмінку, друге – оксид. Якщо елемент може утворювати кілька оксидів, то у назві оксиду, після назви елемента вказують у дужках його ступінь окиснення (римською цифрою, без знаків “–” чи “+”). Іноді оксиди складу ЕО називають монооксидами, ЕО2 – діоксидами тощо. Деякі оксиди мають тривіальні назви
Деякі бінарні сполуки елементів з Оксигеном
| Формула | Графічна формула | Назва |
| Н2О | | гідроген оксид, вода |
| СО2 | | карбон (IV) оксид, карбон діоксид, вуглекислий газ |
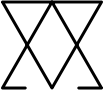
| N2O5 | 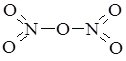 | нітроген (V) оксид, нітроген пентаоксид, нітратний ангідрид |
| Н2О2 | 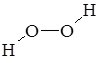 | гідроген пероксид |
| BaO2 |  | барій пероксид |
Основні способи одержання оксидів
Взаємодія простих речовин з киснем, що супроводжується виділенням тепла і світла – горіння:
а) металів: 4Al + 3O2 = Al2O3; 2Сu + O2 = 2CuO;
Таким способом неможливо одержати оксиди лужних металів, які при взаємодії з киснем утворюють пероксиди або надпероксиди (супероксиди):
2Na + O2 = Na2O2, К + O2 = КO2,
тому оксиди таких елементів одержують іншими методами:
Na2O2 + 2Na = 2Na2O; 4КO2 = 2К2O + 3O2
б) неметалів: 2Н2 + O2 = 2Н2O; С + О2 = СО2.
2. Взаємодія складних речовин з киснем:
а) неорганічних: 2H2S + 3O2 = 2H2O + 2SO2; 2SO2 + O2 = 2SO3;
б) органічних: СН4 + 2O2 = СО2 + 2Н2O; С2Н5ОН + 3O2 = 2СО2 + 3Н2O.
3. Термоліз складних речовин:
а) оксидів: 2PbO2 = 2PbO + O2; 2N2O5 = 4NO2 + O2;
а) гідроксидів: Сu(OH)2 = CuO + H2O; 2Fe(OH)3 = Fe2O3 + 3H2O;
а) кислот: 4НNO3 = 4NO2 + 2H2O + O2; H2SO3 = SO2 + H2O;
а) солей: СаСO3 = СаO + СO2; NH4NO3 = N2O + 2H2O;
Існують специфічні способи добування деяких оксидів, їх розглянуто при вивченні відповідних елементів.
Класифікація оксидів
Усі оксиди поділяють на солетвірні і несолетвірні (індиферентні) (схема 13.1).
Несолетвірні (індиферентні) оксиди не утворюють солей у реакціях з кислотами і основами. Таких оксидів 4: карбон (ІІ) оксид СО, силіцій (ІІ) оксид SiO, нітроген (І) оксид N2O, нітроген (ІI) оксид NO. Однак, відомий спосіб одержання натрій форміату базується на реакції:
СО + NaOH = HCOONa (тиск 15 атмосфер).
Солетвірні оксиди у реакціях з кислотами або основами утворюють солі:
СаО + H2SO4 = CaSO4 + H2O; CO2 + 2NaOH = Na2CO3 + H2O.
Серед солетвірних виділяють основні, кислотні та амфотерні оксиди.
Основні – оксиди, гідрати яких – основи. Основними є оксиди лужних (Li, Na, K) і лужноземельних (Ca, Sr, Ba) металів, а також оксиди Cu (II), Fe (II) та Fe (III). У них переважно реалізується іонний хімічний зв’язок, за н. у. усі вони – тверді речовини.
Фізичні властивості оксидів
За н.у. оксиди перебувають у газоподібному (N2O, CO2), рідкому (H2O, SO3) або твердому (оксиди металів) стані.
Хімічні властивості основних оксидів
1. Взаємодія з водою з утворенням лугів:
Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Оксиди Cu (II), Fe (II) та Fe (III) з водою не взаємодіють.
2. Взаємодія з кислотами з утворенням солей та води:
Li2O + 2HCl = 2LiCl + H2O; СuO + H2SO4 = CuSO4 + Н2О.
3. Взаємодія з кислотними та амфотерними оксидами з утворенням солей:
K2O + CO2 = K2CO3; Na2O + Al2O3 = 2NaAlO2;
FeO + SO3 = FeSO4; BaO + ZnO = BaZnO2.
4. Взаємодія з амфотерними гідроксидами з утворенням солей та води:
Na2O + Al(OН)3 = 2NaAlO2 + 3Н2О.
5. Участь в окисно-відновних реакціях:
Fe2O3 + 2Al = Al2O3 + 2Fe; 3CuO + 2NH3 =3Cu + N2 + 3H2O.
Кислотні – оксиди, гідрати яких – кислоти. Ці оксиди ще називають ангідридами кислот. Кислотними є оксиди неметалів та металів у високих (+5 – +7) ступенях окиснення. В кислотних оксидах реалізується ковалентний полярний хімічний зв’язок, за н.у. вони перебувають у газовому (СО2, SO3), рідкому (N2O5, Cl2O7) або твердому (Р2О5, Mn2O7) стані.
Хімічні властивості кислотних оксидів.
1. Взаємодія з водою з утворенням кислот:
SO3 + H2O = H2SO4; P2O5 + 3H2O = 2H3PO4.
Кислотні оксиди, утворені елементами, що перебувають у проміжному ступені окиснення у цьому випадку утворюють дві кислоти:
2N+4O2 + H2O = HN+3O2 + HN+5O3; 2Cl+6O3 + H2O = HCl+5O3 + HCl+7O4.
2. Взаємодія з лугами з утворенням солей:
СO2 + Ca(OH)2 = Ca(HCO3)2; SO3 + 2NaOH = Na2SO4 + H2O.
Кислотні оксиди, утворені елементами, що перебувають у проміжному ступені окиснення у цьому випадку утворюють дві солі:
2N+4O2 + 2NaOH = NaN+3O2 + NaN+5O3 + H2O.
3. Взаємодія з основними та амфотерними оксидами з утворенням солей:
P2O5 + 3Na2O + = 2Na3PO4; SO3 + ZnO = ZnSO4.
4. Взаємодія з амфотерними гідроксидами з утворенням солей та води:
3N2O5 + 2Al(OН)3 = 2Al(NO3)3 + 3Н2О.
5. Взаємодія у розчинах із середніми солями відповідних кислот з утворенням кислих солей (якщо це можливо):
СO2 + СаСО3 + Н2О = Са(НСO3)2.
6. Участь в окисно-відновних реакціях:
С+4О2 + С0 = 2С+2О; 4Cr+6O3 + C–42H5OH = 2Cr+32O3 + 2C+4O2 + 3H2O;
S+4O2 + 2H2S–2 = 3S0 + 2H2O; Mn+4O2 + 4HCl–1 = Mn+2Cl2 + Cl02 + 2H2O.
Амфотерні оксиди – залежно від умов виявляють властивості основних або кислотних оксидів. Їх утворюють лише метали побічних підгруп, які перебувають у проміжних ступенях окиснення, а також берилій Be та алюміній Al. В амфотерних оксидах реалізується іонно-ковалентний хімічний зв’язок, за н.у. – усі вони тверді речовини.
Хімічні властивості амфотерних оксидів
З водою не реагують, амфотерні гідроксиди одержують іншими методами (див. Амфотерні гідроксиди).
Аналогічно з основними, реагують з кислотами та кислотними оксидами, утворюючи солі:
Al2O3 + 6HCl = 2AlCl3 + 3H2O; Cr2O3 + 3SO3 = Cr2(SO4)3.
Аналогічно з кислотними, реагують у розплаві з основами та основними оксидами, утворюючи солі:
ZnO + 2KOH = K2ZnO2 + H2O; Al2O3 + Na2O = 2Na2AlO2.
Воду теж можна розглядати як амфотерний оксид, оскільки вона при дисоціації утворює іони Н+ і ОН–:
Н2О ↔ Н+ + ОН–, або Н2О + Н2О ↔ Н3О+ + ОН–,
і реагує з кислотними та основними оксидами з утворенням кислот або основ відповідно.
Застосування оксидів розглянуто при вивченні хімії елементів.
4 ЗНАЧЕННЯ ХІМІЧНОГО ЕЛЕМЕНТА В МЕДИЦИНІ ТА ТЕХНІЦІ
Як вільний Арсен, так і всі його сполуки – сильні отрути. Смертельна доза для людини Аs2O3 0,1 г (білий миш’як).
При отруєнні виникає порушення нервової системи, загальна слабкість, параліч, в результаті наступає смерть. При легкому отруєнні – рвота, діарея, сильні болі в животі.
Для лікування вводять підшкірно апоморфін, а як протиотруту дають свіжеприготовлену суміш MgO і Fe (ОН)3, збовтану з Fe2(SO4)3 по чайній ложці через кожні 10 хв.
Використання.
1. Сполуки Арсену при виправці шкіри і хутра.
2. В сільському господарстві для боротьби із шкідниками.
3. В медицині Na2HAsO4 KAsO2, входить до складу новарсенолу.
4. Входить до складу сплавів (твердість, стійкість до дії окисників), які використовують як напівпровідники в електронній техніці.
5. Як мікроелемент Арсен стимулює життєдіяльність організму людини і міститься в сечі та тканинах тварин і клітинах рослин.
Застосовують арсен для виготовлення деяких сплавів, особливо чистий — у напівпровідниковій техніці; сполуки його використовують як інсектициди, деякі — у медицині.
ПЕРЕЛІК ПОСИЛАНЬ НА ДЖЕРЕЛА
1 Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім.. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
2 Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Донецьк : Донбас, 2004. — ISBN 966-7804-14-3.