
Ім'я файлу: Конструювання каркасних молекул. Стратегія формування малих, сер
Розширення: docx
Розмір: 145кб.
Дата: 29.01.2021
скачати
Пов'язані файли:
Конструювання каркасних молекул. Стратегія формування малих, сер
Противірусні засоби.docx
Сонячні елементи.docx
Сонячні елементи.pptx
Спеціальні сплави для вимірювальної та нагрівальної апаратури. Н
Спеціальні сплави для вимірювальної та нагрівальної апаратури. Н
Темплатні синтези. Основні підходи і принципи реалізації..docx
Темплатні синтези. Основні підходи і принципи реалізації..pptx
Мікровикладання.docx
Система вищої освіти у Великобританії.docx
Розширення: docx
Розмір: 145кб.
Дата: 29.01.2021
скачати
Пов'язані файли:
Конструювання каркасних молекул. Стратегія формування малих, сер
Противірусні засоби.docx
Сонячні елементи.docx
Сонячні елементи.pptx
Спеціальні сплави для вимірювальної та нагрівальної апаратури. Н
Спеціальні сплави для вимірювальної та нагрівальної апаратури. Н
Темплатні синтези. Основні підходи і принципи реалізації..docx
Темплатні синтези. Основні підходи і принципи реалізації..pptx
Мікровикладання.docx
Система вищої освіти у Великобританії.docx
Міністерство освіти і науки України
Львівський національний університет імені Івана Франка
Хімічний факультет
Кафедра органічної хімії
Реферат
На тему:
“ Конструювання каркасних молекул. Стратегія формування малих, середній та великих циклів.”
Виконала
Студентка група ХМХМ-11з
Нечепоренко К. В.
Оцінка ______
Львів 2021
Зміст
1.1 Тетраедран 7
1.2 Кубан 8
1.3 Додекаедран 9
Вступ
В останні часи в органічній хімії розвивається напрямок синтезу поліедричних (каркасних) сполук. Зокрема, вже синтезовано призман, кубан, о-карборан і похідні тетраедрану. Обговоріть основні труднощі синтезу різних каркасних сполук. Чи можливо теоретично передбачити хімічну стабільність і можливість синтезу таких сполук? Запропонуйте можливе застосування таких сполук та їх похідних.
Каркасні сполуки
Каркасні сполуки або поліедрани – це поліциклічні сполуки об’ємної структури. Для синтезу поліедранів, як і всіх циклічних сполук, використовують такі методи:
внутрішньомолекулярна реакція Вюрца;
піроліз кальцієвих, барієвих або торієвих солей дикарбонових кислот;
реакція циклоприєднання;
внутрішньомолекулярна ізомеризація та інші.
Синетез каркасних сполук є надзвичайно трудомістким процесом, який включає багато стадій. Для демонстрації складності синтезу поліедричних сполук розглянемо процес одержання кубану оригінальним методом який провів Філіп Ітон в 1964 р.
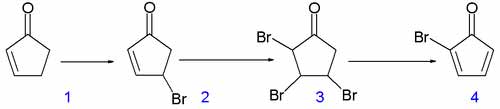
В якості вихідного реагенту використовують циклопент-2-енон, який почергово бромують в дві стадії та елімінують з утворенням бромциклопентадієнону.
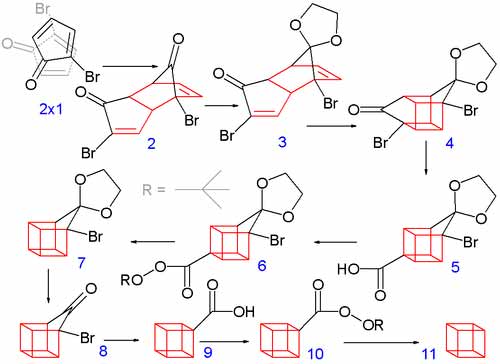
Даний реагент самовільно димеризується по реакції Дільса-Альдера. Далі одну з кетогруп захищають етиленгліколем і проводять фотохімічну внутрішньомолекулярну реакцію [2+2] циклоприєднання. Галогенкетонне угрупування переводять в карбоксалат-йон, використовуючи для цього перегрупування Фаворського, і проводять декарбоксилювання. На кінець зняття кетального захисту, повторне перегрупування Фаворського і декарбоксилювання призводять до утворення кубану.
Даний приклад показує труднощі синтезу каркасних сполук. Кожна стадія має невисокий вихід продукту, який до того ж потрібно виділяти з реакційної суміші та очищати.
Циклічні, а особливо каркасні сполуки з малими циклами досить нестійкі внаслідок внутрішнього напруження. Молекули прагнуть прийняти ту конформацію в якій її загальна енергія мінімальна. На внутрішню енергію молекули згідно конформаційного аналізу впливають в основному чотири головних чинники:
«байєрівське» напруження (зумовлює зміну валентних кутів);
«пітцерівське» (торсійне) напруження (зумовлює інверсію (зміну конформації) циклу);
вандерваальсівське напруження незв’язаних атомів;
напруження пов’язане зі зміною довжини зв’язків
Енергію напруження визначають як різницю експериментально визначених ентальпій утворення досліджуваної речовини та стандарту. Однак, якщо речовина ще не синтезована, енергію напруження можна обрахувати використовуючи методи квантової механіки. Методом молекулярної механіки будується поверхня потенціальної енергії. Якщо на такій поверхні є мінімуми то дана молекула теоретично може існувати. Однак такі обчислення із-за складності можна робити тільки використовуючи комп’ютер.
Для прикладу розглянемо теоретично побудований переріз поверхні потенціальної енергії ізомеризації тетраедрану, який поки що є єдиним несинтезованим платоновим вуглеводнем.
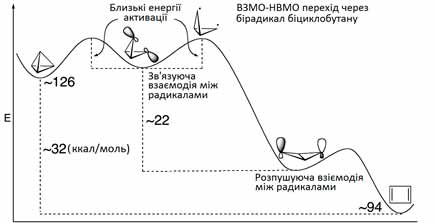
Як видно з діаграми, енергія тетраедрану практично дорівнює енергії бірадикалу. Тому він досить легко ізомеризується до циклобутадієну, який також є малостійкою молекулою. Великий енергетичний бар’єр між тетраедраном і циклобутадієном свідчить про неможливість зворотнього перетворення.
Якщо напруження в молекулі перевищує енергію зв’язку то вона є термодинамічно нестабільною.
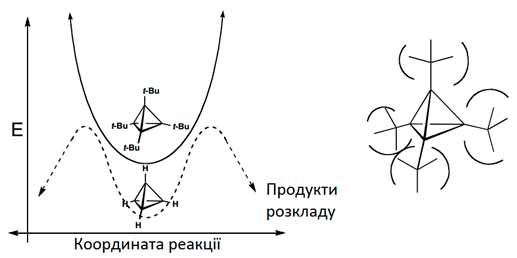
Однак молекули кубану та похідні тетраедрану, які мають велике напруження існують завдяки кінетичній стабільності. Стабільність Кубану пояснюється відсутністю стабільних інтермедіатів розкладу, а тому високою енергією активації ізомеризації. Тетра-трет-бутилтетраедран має найбільшу енергію напруження в розрахунку на один С–С зв’язок тетраедранового скелету з усіх відомих сполук. Стабільність цієї молекули пояснюється ефектом «корсет», який утворюють об’ємні трет-бутильні замісники. Вони ніби розтягують молекулу у різні сторони збільшуючи відстань між зв’язаними атомами карбону тетраедрану. Пов’язаний з цим ріст напруження системи забезпечує порівняно високі активаційні бар’єри любого типу реакції, яка веде до руйнування тетраедричного скелету. Для незаміщеного тетраедрану такий бар’єр є низький.
Кубан має найбільшу густину з усіх вуглеводнів, а тому він є потенційним висококалорійним паливом. Октанітрокубан суміщає в одній молекулі властивості ідеального пального (висока енергомісткість та висока густина), так і окисника, причому з унікальною стехіометрією вибухового розкладу
C8N8O16 → 8CO2 + 4N2
Також похідні кубану є перспективними матеріалами в нанотехнології. о-Карборан використовується в органічному синтезі як каталізатор.
Створення молекул, які мають форму платонових тіл, само по собі становить досягнення, яке ярко демонструє інтелектуальну силу і майстерність сучасної науки. В цьому випадку хімія має право заявити, що вона може створювати дещо воістину естетично приваблююче. Не менш важливі і інші аспекти цих робіт. Це перш за все знання, добуті ціною великих зусиль, потрачених на находження реальних шляхів до поставленої мети. Найбільш важливе «виправдання» цих робіт являє собою збагачення сучасної органічної хімії величезним об’ємом даних, що стосуються несподіваних властивостей тетраедрану, кубану, додекаедрану та інших поліедричних сполук.[1]
Тетраедран
Тетраедран - теоретично можливе хімічна сполука з формулою C4H4, каркасний вуглеводень, атоми вуглецю якого розташовані в просторі в кутах тетраедра.
Вперше структура тетраедрана, заміщений в вершинах трет-бутилен отримана в 1978 році Гюнтером Майєром [2]. Незаміщені тетраедран так і не вдалося синтезувати. Це пов'язано з тим, що кут між атомами вуглецю в ньому становить всього 60 °, що значно менше оптимального 109,5 °. Це створює велику напругу в молекулі і вона виявляється вкрай нестабільна. У синтезованих похідних тетраедрана, заступники в вершинах створюють свого роду «корсет», стримуючий структуру.
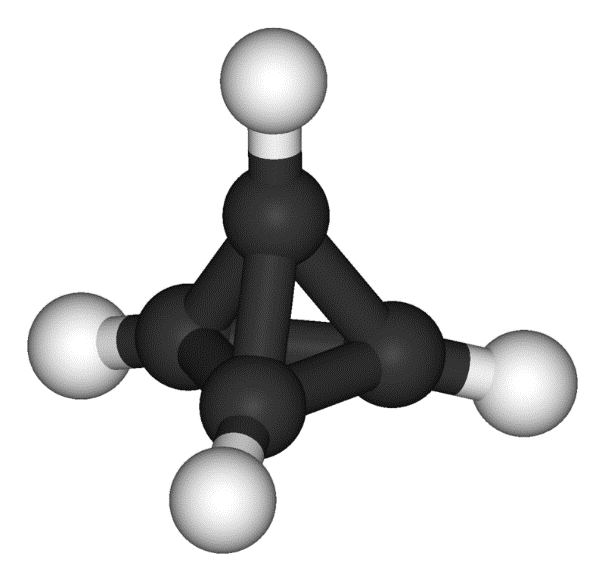
Рис.1. Тетраедран.
Кубан
Вуглевод у формі куба. Він має формулу C8H8 і називається Кубан (рис. 2). Кубан був отриманий в 1964 р 13 - стадійним синтезом. Ця речовина цікаво тим, що має найбільшу щільність серед всіх вуглеводнів. Крім того, завдяки тому, що кут 90◦ між зв'язками C-C значно відрізняється від кута 109,5◦, характерного для звичайних граничних вуглеводнів, молекула кубана має досить високу енергію. Укупі з високою щільністю це робить Кубан перспективною речовиною для зберігання і вивільнення енергії. Так, синтезований в 1999 р октанітрокубан C8 (NO2) 8 - це потенційне вибухову речовину. Воно здатне дуже швидко розкладатися з виділенням великої кількості газів - CO2 і N2. У Октаедр кожна вершина пов'язана з чотирма іншими, тому можна було б уявити молекулу C6, в якій чотиривалентність атоми вуглецю утворюють октаедр. Однак така молекула дуже нестійка через кутового напруги, викликаного тим, що кут між зв'язками C-C - всього 60◦ - сильно відхиляється від нормального кута 109,5◦[3]
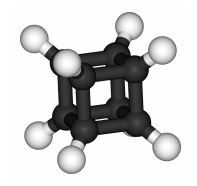
Рис.2. Молекула кубана C8H8
Додекаедран
Додекаедран - це хімічна сполука, вуглеводень з формулою C20Н20, атоми вуглецю якого розташовані у вигляді вершин (кутів) правильного додекаедра. Кожен вуглець пов'язаний з трьома сусідніми атомами вуглецю і з атомом водню. Це з'єднання є одним з трьох можливих платонових вуглеводнів, два інших - Куба і тетраедран. Додекаедран не зустрічається в природі і не має значного використання. Він був синтезований Лео Пакетта в 1982 році, в першу чергу для «естетично приємною симетрії додекаедричного каркаса». Протягом багатьох років додекаедран був найпростішою реальною молекулою на основі вуглецю з повною ікосаедричною симетрією. Бакмінстерфуллерен (C60), відкритий в 1985 році, також володіє такою ж симетрією, але в ньому в три рази більше атомів вуглецю і на 50% більше атомів в цілому[4].
Кут між зв'язками C-C в кожному атомі вуглецю становить 108 °, що є кут між сусідніми сторонами правильного п'ятикутника. Це значення дуже близько до 109,5 ° центрального кута у вигляді правильного тетраедра. У результаті, існує мінімальний кут деформації. Проте, молекула має значні рівні деформації кручення в результаті затемненій конформації уздовж кожного краю конструкції. Молекула має ідеальну ікосаедрічну симетрію, про що свідчить її протонний ЯМР спектр, в якому всі атоми водню з'являються при одному хімічному зсуві 3,38 м.д. на відміну від бакмінстерфуллерен, додекаедран не має делокалізованних електронів і, отже, не має ароматичності.[5]
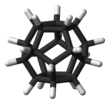
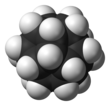
Рис.3. Додекаедран
Висновки:
Поширення симетричних структур в хімії полягає в тому, що такі структури бувають дуже стійкі, тобто мають найменшої енергією серед ряду схожих, але менш симетричних молекул. А прагнення до зменшення енергії це одна з головних рушійних сил хімічних реакцій.
Хімічні властивості каркасних сполук схожі до ненасичених вуглеводнів. Внаслідок високої напруженості вони легко ізомеризуються, гідруються та окиснюються.
Для того, щоб передбачити можливість синтезу сполуки потрібно скласти ретросинтетичну схему і за допомогою методів молекулярного моделювання побудувати поверхню потенціальної енергії та проаналізувати енергії активації переходів. На даному етапі розвитку науки це можливо зробити.
Так як синтез поліедричних сполук досить дорогий – широкого застосування в промисловості дані речовини не мають. Однак властивості деяких речовин даного типу мають інтерес.
Список використаної літератури
Journal of the American Chemical Society. - 1988. - Vol. 110, No. 4. - С. 1303-1304
G. Maier, S. Pfriem, U. Schäfer and R. Matusch. Tetra-tert-butyltetrahedrane (англ.) // Angewandte Chemie International Edition in English. — 1978. — Vol. 17, no. 7. — P. 520–521. — doi:10.1002/anie.197805201
Ерёмин В. В. Математика в химии. –– 2-е изд., испр. –– М.: МЦНМО, 2016. –– 64 с.
Chemical Reviews. - 1989. - Vol. 89, No. 5. - С. 1051-1065
Смит В., Бочков А., Кейпл Р. Органический синтез: Наука и искусство. - М.: Мир, 2001. - С. 378-383