
КУРСОВАЯ РАБОТА
 Производство серной кислоты
Производство серной кислотыРазработал учитель химии
Дьяконова Татьяна Сергеевна
МКОУ «Хабайдакской основной школы»
Реферат
Курсовая работа - 20 с., рисунка - 1, источников - 3.
КОЛЧЕДАН; АНГИДРИД; ВОЗДУХ; КАТАЛИЗАТОР; МОНОГИДРАТ.
Целью работы являлось изучение производства серной кислоты.
В данной работе изучена характеристика исходного сырья для производства серной кислоты. Были исследованы физико-химические показатели. Изучена возможность производства серной кислоты.

Содержание
Введение…………………………………………………………………….........5
Сырьевые источники получения серной кислоты………………..…...…....6
2 Краткое описание промышленных способов получения
серной кислоты…………………………………………………..………..…….7
3 Выбор катализатора…………………………………………………………..11
4 Обоснование способа производства…………………………………………12
5 Стадии и химизм процесса…………………………………………………...13
6 Конденсация серной кислоты……………………………………………….15
7 Технологическая схема производство серной кислоты из железного колчедана……………………………………………………………….……..…16
Заключение ………………………………………………………………….…...19
Список использованных источников …………………………………….…….20

Введение

Серная кислота - один из основных многотоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета и запаха, при обычной температуре находится в жидком состоянии, в концентрированном виде не корродирует черные металлы. В то же время, серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава: п SО3 · т Н2О.
Моногидрат серной кислоты - бесцветная маслянистая жидкость с температурой кристаллизации 10,37 оС, температурой кипения 296,2 оС и плотностью 1,85 т/м3. С водой и оксидом серы (VI) он смешивается во всех отношениях, образуя гидраты состава Н2SО4 · Н2О, Н2SО4 · 2Н2О, Н2SО4 · 4Н2О и соединения с оксидом серы Н2SО4 · SО3 и Н2SО4 ·2SО3.
Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации.
Температура кипения серной кислоты также зависит от ее концентрации, то есть состава системы "оксид серы (VI) - вода". С повышением концентрации водной серной кислоты температура ее кипения возрастает и достигает максимума 336,5 оС при концентрации 98,3 %, что отвечает азеотропному составу, а затем снижается. Температура кипения олеума с увеличением содержания свободного оксида серы (VI) снижается от 296,2 оС (температура кипения моногидрата) до 44,7 оС, отвечающей температуре кипения 100 %-ного оксида серы (VI).
При нагревании паров серной кислоты выше 400 оС она подвергается термической диссоциации по схеме:
400оС 700 оС
2 Н2SО4 <=> 2Н2О + 2SО3 <=> 2Н2О + 2SО2 + О2.
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60 %), а также в производстве красителей (от 2 до 16 %), химических волокон (от 5 до 15 %) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других отраслях промышленности.
 1 Сырьевые источники получения серной кислоты
1 Сырьевые источники получения серной кислотыСырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики, хотя кларк ее равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов метало, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV).
При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
 2 Краткое описание промышленных способов получения серной кислоты
2 Краткое описание промышленных способов получения серной кислотыПроизводство серной кислоты из серусодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы:
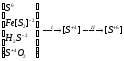
где I – стадия получения печного газа (оксида серы (IV)),
II – стадия каталитического окисления оксида серы (IV) до оксида серы (VI) и абсорбции его (переработка в серную кислоту).
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа и другие механические и физико-химические операции.
В общем случае производство серной кислоты может быть выражено в следующем виде:
Сырье
 подготовка сырья
подготовка сырья  сжигание (обжиг) сырья
сжигание (обжиг) сырья 
 очистка печного газа
очистка печного газа  контактирование
контактирование  абсорбция
абсорбцияконтактированного газа
 серная кислота
серная кислотаКонкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV), наличия или отсутствия стадии абсорбции оксида серы (VI).
В зависимости от того, как осуществляется процесс окисления SО2 в SО3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SО2 в SО3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SО3 + Н2О
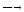 Н2SО4
Н2SО4При проведении процесса по нитрозному (башенному) методу в
качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным
продуктом является серная кислота:
 SО3 + N2О3 + Н2О
SО3 + N2О3 + Н2О 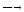 Н2SО4 + 2NО
Н2SО4 + 2NОВ настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FеS2 + 11О2 = 2Fе2S3 + 8SО2,
каталитическое окисление оксида серы (IV) избытком кислорода печного газа:
2SО2 + О2
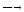 2SО3
2SО3абсорбция оксида серы (VI) с образованием серной кислоты:
SО3 + Н2О
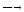 Н2SО4
Н2SО4По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий.
2 Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей. К ним относятся:
– особая конструкция печей для получения печного газа;
повышенное содержание оксида серы (IV) в печном газе;
отсутствие стадии предварительной очистки печного газа.
Последующие операции контактирования оксида серы (IV) по физико-химическим основам и аппаратурному оформлению не отличаются от таковых для процесса на основе колчедана и оформляются обычно по схеме ДК-ДА. Термостатирование газа в контактном аппарате в этом методе осуществляется обычно путем ввода холодного воздуха между слоями катализатора
3 Существует также способ производства серной кислоты из сероводорода, получивший название "мокрого" катализа, состоит в том, что смесь оксида серы (IV) и паров воды, полученная сжиганием сероводорода в
токе воздуха, подается без разделения на контактирование, где оксид серы (IV) окисляется на твердом ванадиевом катализаторе до оксида серы (VI). Затем газовая смесь охлаждается в конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт.
 Таким образом, в отличие от методов производства серной кислоты из колчедана и серы, в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI) и весь процесс включает только три последовательные стадии:
Таким образом, в отличие от методов производства серной кислоты из колчедана и серы, в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI) и весь процесс включает только три последовательные стадии:1 Сжигание сероводорода:
Н2S + 1,5О2 = SО2 + Н2О
с образованием смеси оксида серы (IV) и паров воды эквимолекулярного состава (1 : 1).
2 Окисление оксида серы (IV) до оксида серы (VI):
SО2+ 0,5О2 <=> SО3
с сохранением эквимолекулярности состава смеси оксида серы (IV) и паров воды (1 : 1).
3 Конденсация паров и образование серной кислоты:
SО3 + Н2О <=> Н2SО4
таким образом, процесс мокрого катализа описывается суммарным уравнением:
Н2S + 2О2 = Н2SО4
Существует схема получения серной кислоты при повышенном давлении. Влияние давления на скорость процесса возможно оценить в кинетической области, где практически отсутствует влияние физических факторов. Повышение давления влияет как на скорость процесса, так и на состояние равновесия. Скорость реакции и выход продукта с повышением давления увеличиваются за счет повышения действующих концентраций SO2 и О2 и увеличения движущей силы процесса. Но при увеличении давления так же возрастают производственные затраты на сжатие инертного азота. Так же увеличивается температура в контактном аппарате, т.к. при высоком давлении и невысокой температуре значение константы равновесия мало, по сравнению со схемой под атмосферным давлением.
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SО2 в SО3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы – снизить выбросы в окружающую среду
вредного компонента SО2.
Для решения этой проблемы велось много различных исследований в различных областях: абсорбция SO2, адсорбция, исследования в изменении конструкции контактного аппарата.
Существую различные конструкции контактных аппаратов:
- контактный аппарат с одинарным контактированием: такой аппарат характеризуется невысокой степенью превращения диоксида серы в триоксид. Недостаток этого аппарата заключается в том, что газ, выходящий из контактного аппарата, имеет высокое содержание диоксида серы, что отрицательно сказывается с экологической точки зрения. Используя данный аппарат, отходящие газы необходимо очистить от SO2. Для утилизации SO2 существует много различных способов: абсорбция, адсорбция,…. Это, конечно, снижает количество выбросов SO2 в атмосферу, но это увеличивает, в свою очередь, количество аппаратов в технологическом процессе, высокое содержание SO2 в газе после контактного аппарата показывает низкую степень использования SO2 , поэтому данные аппараты в производстве серной кислоты не используюися.
- контактный аппарат с двойным контактированием: ДК позволяет достичь того же минимального содержания SO2 в выхлопных газах, что и после химической очистки. Метод основан на известном принципе Ле-Шателье, согласно которому удаление одного из компонентов реакционной смеси сдвигает равновесие в сторону образования этого компонента. Сущность метода заключается в проведении процесса окисления диоксида серы с выделением триоксида серы в дополнительном абсорбере. Метод ДК позволяет перерабатывать концентрированные газы.
- контактный аппарат с промежуточным охлаждением.
Сущность метода заключается в том, что газ, поступающий в
контактный аппарат, пройдя через слой катализатора, попадает в теплообменник, там газ
 охлаждается, затем поступает на следующий слой катализатора. Этот метод так же увеличивает степень использования SO2 и содержание его в выхлопных газах.
охлаждается, затем поступает на следующий слой катализатора. Этот метод так же увеличивает степень использования SO2 и содержание его в выхлопных газах. 3 Выбор катализатора
3 Выбор катализатораНаиболее активным катализатором является платина, однако она вышла из употребления вследствие дороговизны и легкой отравляемости примесями обжигового газа, особенно мышьяком. Окись железа дешевая, но при обычном составе газа – 7 % SO2 и 11 % О2 она проявляет каталитическую активность только при температурах выше 625 0С, т.е. когда хр 70 %, и поэтому применялась лишь для начального окисления SO2 до достижения хр 50-60 %. Ванадиевый катализатор менее активен, чем платиновый, но дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина; он оказался наиболее рациональным и только он применяется в производстве серной кислоты. Ванадиевая контактная масса содержит в среднем 7 % V2O5; активаторами являются окислы щелочных металлов, обычно применяют активатор К2О; носителем служат пористые алюмосиликаты. В настоящий момент катализатор применятся в виде соединения SiO2, K и/или Cs, V в различных пропорциях. Такое соединение оказалось наиболее устойчивым к кислоте и наиболее стабильным. Во всем мире его более корректное названия "ванадий - содержащий". Такой катализатор разработан специально для работы с невысокими температурами, что приводит в меньшим выбросам в атмосферу. Кроме того такой катализ дешевле нежели калий/ванадиевый. Обычные ванадиевые контактные массы представляют собой пористые гранулы, таблетки или кольца.
 4 Обоснование способа производства
4 Обоснование способа производстваПолучение серной кислоты из сероводорода (мокрый катализ) на Пермском нефтеперерабатывающем заводе является малотоннажным производством (65тыс. тонн в год). В основном, это производство создано для того, чтобы снизить выбросы серосодержащих газов и максимально перерабатывать сырье, которое в данном случае является отходом процесса гидроочистки нефти.
Помимо использования сероводорода, в процессе получения серной кислоты протекают 3 реакции:
Н2S + 1,5О2 = SО2 + Н2О
SО2 + 0,5О2 <=> SО3
SО3 + Н2О <=> Н2SО4
Эти три реакции протекают с выделением значительного количества тепла, которое используется для различных нужд цеха производства серной кислоты и в различных целях предприятия: получение пара, который используется в данном производстве, получение пара высокого давления, который используют другие установки, подогрев воздуха, поступающий в котлы для сжигания сероводорода и в контактный аппарат.
Преимущество получения серной кислоты из сероводорода заключается в том, что данный процесс максимально использует и сероводород, и диоксид серы, что в значительной мере снижает выбросы в атмосферу, при проведении процесса, состоящего из 3 реакций, используются невысокие температуры и атмосферное давление, что значительно снижает энергозатраты по сравнению со схемой, которая применяет высокое давление. С учетом того, что в результате технологического процесса выделяется большое количество тепла, процесс, благодаря этому, протекает автотермично.
 5 Стадии и химизм процесса
5 Стадии и химизм процессаПроцесс получения серной кислоты методом "мокрого" катализа состоит из следующих основных стадий.
1 Получение сернистого ангидрида (SO2) путем сжигания сероводородсодержащего газа по следующей реакции:
2H2S + 3O2 = 2SO2 + 2 H2O
2 Охлаждение дымовых газов и утилизация тепла реакции горения сероводорода в котле-утилизаторе с получением водяного пара.
3 Окисление сернистого ангидрида до серного ангидрида (SO3) на ванадиевом катализаторе в контактном аппарате (конвертере) R-104 по следующей реакции:
2SO2 + O3 = 2 SO3
4 Получение серной кислоты (H2SO4) путем конденсации в конденсаторе WSA У-109 по реакции:
SO3 + H2O = H2SO4
5 Для получения улучшенной серной кислоты (содержание окислов азота N2O3 менее 0,5 ppm) предусмотрена схема подачи гидразингидрата в поток серной кислоты, поступающей на участок концентрирования серной кислоты.
Гидразинсульфат, полученный при добавлении гидразина к серной кислоте, взаимодействует с нитрозилсернистой кислотой, обуславливающей содержание N2О3 в продуктовой кислоте:
4
 NOSO3H + N2H4· H2SO4 3N2 + 5H2SO4
NOSO3H + N2H4· H2SO4 3N2 + 5H2SO4Избыток гидразина окисляется с образованием элементарного азота:
 N2H4·H2SO4 + O2 N2 +2H2O + H2SO4
N2H4·H2SO4 + O2 N2 +2H2O + H2SO4 Химический состав серной кислоты выражается формулой H2SO4. Структурная формула серной кислоты выглядит следующим образом:

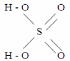
Относительная молекулярная масса серной кислоты - 98,08 кг/кмоль.
Безводная серная кислота содержит 100 % H2SO4 или 81,63 % SO3 и 18,37 % мас. H2O. Это бесцветная маслянистая жидкость не имеющая запаха с температурой кристаллизации 10,37 ºС. Температура кипения безводной серной кислоты при давлении 1,01·105 Па (760 мм рт.ст.) составляет 298,2 ºС. Плотность при 20 ºС составляет 1830,5 кг/м3.
С водой и сернистым ангидридом серная кислота смешивается в любых пропорциях.
В процессе производства серной кислоты для окисления сернистого ангидрида в серный применяются ванадиевый катализатор. Он представляет собой пористое вещество, на которое нанесено активное комплексное соединение, содержащее пятиокись ванадия V2O5.
В данном случае применяется катализатор марки VK-WSA фирмы "Хальдор Топсе".
Температура зажигания катализатора 400-430 ºС. При температуре выше 620 ºС активность катализатора быстро снижается, т.к. при этом распадается активный комплекс, содержащий пятиокись ванадия (V2O5), а также разрушается структура носителя, что приводит к разрушению катализатора и образованию пыли.
Срок службы катализатора не менее 4 лет.
 6 Конденсация серной кислоты
6 Конденсация серной кислотыКонденсация парой серной кислоты. В некоторых случаях, газ, используемый для получения серной кислоты, не содержит вредных примесей (мышьяка, фтора). Тогда экономически целесообразно не подвергать такой газ промывке в специальной аппаратуре, а передавать сразу на контактирование. Обычно его не подвергают также осушке, поэтому такой процесс называют мокрым катализом (например, получение серной кислоты из сероводорода). Газ, поступающий на стадию получения серной кислоты, содержит SO3 и Н20, и образование серной кислоты происходит не в результате абсорбции серного ангидрида растворами кислоты, а вследствие образования паров H2SO4 и конденсации их в башне с насадкой или другой аппаратуре, предназначенной для этого процесса.
При медленном охлаждении газа, содержащего SO3 и Н2О, можно провести процесс конденсации паров серной кислоты без образования тумана. Однако скорость процесса при этом мала и часто экономически выгоднее вести охлаждение с большей скоростью, допуская образование некоторого количества тумана, а затем выделить этот туман из газовой смеси. Чтобы туман легче осаждался в фильтрах, процесс ведут при таких условиях, в которых образуются крупные капли. Этому соответствует невысокое значение возникающего пересыщения и более высокая температура орошающей кислоты, чем при обычном процессе абсорбции ("горячая" абсорбция).
Конденсация кислоты идет внутри стеклянных трубок, в которые поступает технологический газ, содержащий пары кислоты. Внутри стеклянных трубок расположены спирали, служащие в качестве центров для осаждения серной кислоты. На конце каждой трубки установлен патронный фильтр (каплеотбойник), предназначенный для улавливания тумана серной кислоты. Внешняя поверхность труб (межтрубное пространство) охлаждается атмосферным воздухом. Очищенный газ с остаточной концентрацией серной кислоты менее 20 ррм и температурой не более 120 градусов цельсия сбрасывается в дымовую трубу.
Давление пара в котле-утилизаторе поддерживается достаточно высоким, чтобы температура теплообменных поверхностей. котла была выше точки росы серной кислоты (275 °С).
Несконденсированный газ из башни-конденсатора по футерованному газоходу через гидравлический затвор поступает в мокрые электрофильтры.
Последние предназначены для улавливания изгазов тумана серной кислоты концентрацией 93— 94 % (масс.). Гидравлический затвор может также служить брызгоуловителем. Очищенный газ выводится в атмосферу. Для первоначального прогрева катализатора в контактном аппарате используют пусковой подогреватель, в котором воздух нагревается за счет сжигания топливного
 7 Технологическая схема производство серной кислоты из железного колчедана
7 Технологическая схема производство серной кислоты из железного колчеданаТехнологическая схема производства серной кислоты из железного колчедана с использованием принципа двойного контактирования ДК—ДА показана на рисунке 1. Колчедан через дозатор подают в печь (1) кипящего слоя. Полученный запыленный обжиговый газ, содержащий 13 % SO2 и имеющий на выходе из печи температуру около 700 °С, подают сначала в котел-утилизатор (3), а затем на стадию сухой очистки от огарковой пыли (в циклоны (4) и в сухой электрофильтр (5)). В котле-утилизаторе (3) происходит охлаждение газа с одновременным получением энергетического водяного пара (давление 4 МПа и температура 450 °С), который может быть использован как в самой установке для компенсации затрат энергии на работу компрессоров и насосов, так и в других цехах завода.
В очистном отделении, состоящем из двух промывных башен (6) и (7), двух пар мокрых электрофильтров (8) и (9) и сушильной башни (10), происходит очистка газа от соединений мышьяка, селена, фтора и его осушка.
Первая полая промывная башня 6 работает в испарительном режиме: циркулирующая кислота охлаждает газ, при этом теплота затрачивается на испарение воды из кислоты, поступающей на орошение. Концентрацию орошающей кислоты в первой башне, равную 40... 50 %-ной H2SO4, поддерживают постоянной путем разбавления 10... 15 %-ной кислотой из второй промывной башни (7). Кислота из второй башни поступает в сборник (18) и после охлаждения возвращается на орошение.
После второй промывной башни газ проходит последовательно две пары мокрых электрофильтров (8) и (9), затем насадочную сушильную башню (10), орошаемую 93...94 %-ной серной кислотой при температуре 28...30 °С. Кислота циркулирует между сушильной башней (10) и сборником (18), часть кислоты отводится как готовая продукция на склад. Для поддержания постоянной концентрации H2SO4 в сборник кислоты 18 вводят 98... 99 %-ную кислоту из моногидратных абсорберов (17) и (20). Для поддержания постоянной температуры на стадии осушки циркулирующую кислоту охлаждают в холодильнике воздушного охлаждения (22). Перед сушильной башней обжиговый газ разбавляют воздухом для снижения в нем концентрации SO2 до 9 % и увеличения избытка кислорода в соответствии с оптимальными условиями окисления диоксида серы.

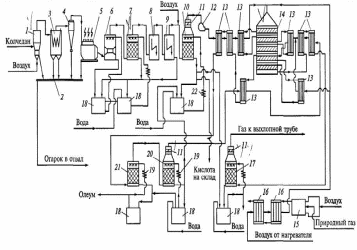
1 — печь; 2 — система гидроудаления огарка; 3 — котел-утилизатор; 4 — циклон с пересыпным устройством; 5 — сухой электрофильтр; 6— полая промывная башня; 7— насадочная промывная башня; 8,9— мокрые электрофильтры; 10— сушильная башня; 11— фильтр-брызгоуловитель; 12 — турбогазодувка; 13 — теплообменники контактного узла; 14 — контактный аппарат; 15 — пусковой подогреватель; 16 — теплообменник; 17 — второй моногидратный абсорбер; 18 — сборник кислоты; 19 — холодильник;20 — первый моногидратный абсорбер; 21 — олеумный абсорбер; 22 — холодильник воздушного охлаждения кислоты
Рисунок 1 - Технологическая схема производства серной кислоты из колчедана по способу ДК—ДА
После сушильной башни обжиговый газ проходит через фильтр-брызгоуловитель (11) и поступает в турбогазодувку (12). В теплообменниках (13) газ нагревается за счет теплоты продуктов реакции до температуры зажигания катализатора (420...440 °С) и поступает на первый слой контактного аппарата, где происходит окисление 74 % SO2 с одновременным повышением температуры до 600°С. После охлаждения до 465°С газ поступает на второй слой контактного аппарата, где степень превращения достигает 86 %, а температура газа возрастает до 514 ºС. После
охлаждения до температуры 450ºС газ поступает на третий слой контактного аппарата, где степень превращения SO2 увеличивается до 94...94,5 %, а температура повышается до 470°С.
Затем в соответствии с требованиями метода ДК—ДА реакционный
газ охлаждают в теплообменниках (13) до 100 °С и направляют на абсорбцию первой ступени: сначала в олеумный абсорбер (21), затем в моногидратный абсорбер (20). После моногидратного абсорбера и фильтра-брызгоуловителя газ вновь нагревают до температуры 430 °С и подают на четвертый слой
 катализатора. Концентрация SO2 в газе составляет теперь 0,75...0,85 %. В четвертом слое происходит окисление остаточного SO2 с конверсией ≈ 80%, сопровождающееся повышением температуры до 449°С. Реакционную смесь вновь охлаждают до температуры 409 °С и направляют на последний (пятый) слой контактного аппарата. Общая степень превращения после пяти стадий контактирования составляет 99,9 %.
катализатора. Концентрация SO2 в газе составляет теперь 0,75...0,85 %. В четвертом слое происходит окисление остаточного SO2 с конверсией ≈ 80%, сопровождающееся повышением температуры до 449°С. Реакционную смесь вновь охлаждают до температуры 409 °С и направляют на последний (пятый) слой контактного аппарата. Общая степень превращения после пяти стадий контактирования составляет 99,9 %.Газовую смесь после охлаждения направляют в моногидратный абсорбер второй ступени абсорбции (17). Непоглощенный газ, состоящий в основном из воздуха, пропускают через фильтр (11) для выделения брызг и тумана и выбрасывают в атмосферу через выхлопную трубу.
Производительность установки составляет до 1500 т/сут по моногидрату.
Расход на 1 т моногидрата: колчедана 0,82 т, воды 50 м3, электроэнергии 82 кВт -ч.
 Заключение
ЗаключениеВ производстве H2SO4 соблюдены основные направления развития химической промышленности:
Технология малоотходная - переход сырья в целевой продукт достигает
Энергосберегающее, так как процесс обеспечивает сам свое энергосбережение.
Эта химическая технология обладает рядом функций:
1 Рациональное использование сырья и энергии.
2 Масштабность и дешевизна.
Поскольку процесс непрерывен, он обладает рядом достоинств:
Большое количество продукта с 1 объема аппарата - высокая интенсивность процесса.
Исключение потерь тепла из-за термодинамичности - нагрев-охлаждение.
Легкость автоматизации.
Также процесс учитывает основные принципы химической технологии:
Наибольшая интенсивность процесса;
Наилучшее использование сырья;
Наибольшее использование энергии.
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SО2 в SО3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы - снизить выбросы в окружающую среду вредного компонента SО2.
Повышение степени превращения SО2 может быть достигнуто разными путями. Наиболее распространенный из них - создание схем двойного контактирования и двойной абсорбции.
 Список используемых источников
Список используемых источников1 Васильев, Б.Т. Технология серной кислоты / Васильев. Б.Т. М.И.Отвагина - М.: Химия, 1985. - 386 с.
2 Кутепов, А.М. Общая химическая технология [Текст]: учебник /А.М. Купетов, Т.И. Бондарева - М.: Высшая школа, 1990. - 223 с.
3 Амелин, А.Г. Производство серной кислоты / Амелин. А.Г. М.: Высшая школа, 1983 г. – 245 с.