
Військовий інститут танкових військ
Національного технічного університету
‘‘Харківський політехнічний інститут’’
Кафедра хімії та бойових токсичних хімічних речовин
КУРСОВА РОБОТА
На тему: Поверхнево-активні речовини: класифікація
та роль у різних галузях діяльності
Виконав:
сержант Павло ОЛЕКСІЄНКО
Керівник:
працівник ЗСУ Наталя ДЕВ’ЯТОВА
Харків – 2020
ЗМІСТ
| ВСТУП ………………………………………………………………………… | 3 | |
| 1. | КОЛОЇДНІ ПОВЕРХНЕВО-АКТИВНІ РЕЧОВИНИ ………………… | 4 |
| | 1.1 Загальна характеристика колоїдних ПАР…….…………………… | 4 |
| | 1.2 Критична концентрація міцелоутворення………………………… | 5 |
| | 1.3 Різновиди колоїдних ПАР …………………….……………………. | 11 |
| | 1.4 Будова міцел ПАР …………………………………………………... | 14 |
| | 1.5 Явище солюбілізації ………………………………………………... | 18 |
| 2. | ЗАСТОСУВАННЯ КОЛОЇДНИХ ПАР ……………………………….. | 21 |
| | 2.1 Миюча дія колоїдних ПАР …………………………………………... | 21 |
| | 2.2 Інші області застосування колоїдних ПАР ..……………..…….... | 25 |
| ВИСНОВКИ ………………………………………………………………….. | 29 | |
| ПЕРЕЛІК ПОСИЛАНЬ ……………………………………………………… | 30 | |
ВСТУП
Поверхнево-активні речовини – хімічні сполуки, які, концентруючись на поверхні розділу фаз, викликають зниження поверхневого натягу. Основною характеристикою ПАР є поверхнева активність – здатність речовини знижувати поверхневий натяг на межі розділу фаз – це похідна поверхневого натягу за концентрацією ПАР.
Найважливішою областю застосування колоїдних ПАР є використання їх як миючих засобів. Але це далеко не єдина область застосування колоїдних ПАР. Адсорбуючись на межах поділу фаз, ПАР модифікують їх. На цьому засновано застосування ПАР у різних процесах, приклади яких наведені в курсовій роботі.
Тому метою даної роботи визначено дослідити загальну характеристику колоїдних ПАР, розглянути їх класифікацію та значення критичної концентрації міцелоутворення, визначити будову міцел та розібратись з явищем солюбілізації. А також дослідити області застосування поверхнево-активних речовин.
1. КОЛОЇДНІ ПОВЕРХНЕВО-АКТИВНІ РЕЧОВИНИ
1.1 Загальна характеристика колоїдних ПАР
За класифікацією дисперсні системи розподіляються на дві групи — ліофільні і ліофобні (оборотні і необоротні). Ліофобні дисперсні системи є термодинамічно нестійкими системами. Ліофільні системи термодинамічно стійкі, а це означає, що вони рівноважні (стан відповідає мінімуму енергії Гіббса), оборотні і утворюються самодовільно як із макрофаз, так і з істинного розчину. Типовими представниками ліофільних дисперсних систем є розчини колоїдних поверхнево-активних речовин.
Колоїдними поверхнево-активними речовинами називають ПАР, здатні утворювати міцелярні системи. Властивості ПАР, як зазначалося вище, зумовлені дифільністю їх молекул. У довголанцюгових ПАР з числом атомів вуглецю n = 10–20, для яких характерний оптимальний баланс гідрофільності і гідрофобності, спостерігаються особливі властивості. При малих концентраціях вони утворюють істинні розчини, із збільшенням концентрації відбувається процес асоціації і утворюються міцели. Цей процес самодовільний, і в системі можливі рівноважні переходи між молекулярним розчином, міцелярною системою, гелем (структурованою міцелярною системою) та твердим тілом.
Міцелярний розчин ПАР – це система термодинамічне стійка, рівноважна і оборотна. Міцели ПАР, на відміну від міцел ліофобних золів, термодинамічне стабільні і не змінюються, доки під дією зовнішніх факторів не зсунеться рівновага в системі.
Класифікація колоїдних ПАР. За властивістю дисоціювати ПАР розділяють на іоногенні(аніоноактивні, катіоноактивні, амфотерні) і неіоногенні.
У аніоноактивних ПАР поверхнево-активні іони заряджені негативно.
До них належать лужні солі жирних кислот (мила) — RСООМе, алкілсульфати — сульфоефіри вищих спиртів та їх солі типу R-O-SO3-Ме; алкіл- і арілсульфонати RSO3Ме — лужні солі високомолекулярних сульфокислот, де R означає насичений вуглеводневий радикал числом атомів – вуглецю 10-20, а Ме іони Nа+, К, NH4.
Катіоноактивні ПАР — це солі амінів [RN+H3]Cl, четвертинних амонійних основ [R(CH3)3N+]Cl, алкілпіридинових сполук. [C5H5N+R]Cl
Поверхнево-активні іони таких речовин заряджені позитивно.
АмфотерніПАР — це алкіламінокислоти RNH2COOH, сульфобетаіни та ін. В залежності від рН вони виявляють аніоно-або катіоноактивні властивості.
НеіоногенніПАР не дисоціюють на іони. Їх одержують взаємодією оксиду етилену із спиртами, фенолами, жирними кислотами та іншими сполуками з полярними групами. Загальна формула неіоногенних ПАР — R(ОСH2СH2)mОН. Гідрофільність їх визначається довжиною оксиетиленового ланцюга. У виробництві фармацевтичних препаратів широко застосовуються оксиетильовані похідні ефірів жирних кислот і сорбітану.
Важливою характеристикою колоїдного ПАР є співвідношення гідрофільних і гідрофобних властивостей, яке визначається числом ГЛБ. В залежності від числа ГЛБ колоїдні ПАР застосовуються як гідрофобні емульгатори (3–6), змочувачі (7–9), миючі засоби (13–15), гідрофільні емульгатори (8–8).
1.2. Критична концентрація міцелоутворення
Доказом утворення міцел ПАР є вигин або злам на залежностях “властивість – концентрація”. Як такі властивості розчину можуть бути використані питома і молярна електричні провідності, поверхневий натяг, мутність, показник заломлення й інші (рис. 1.1).
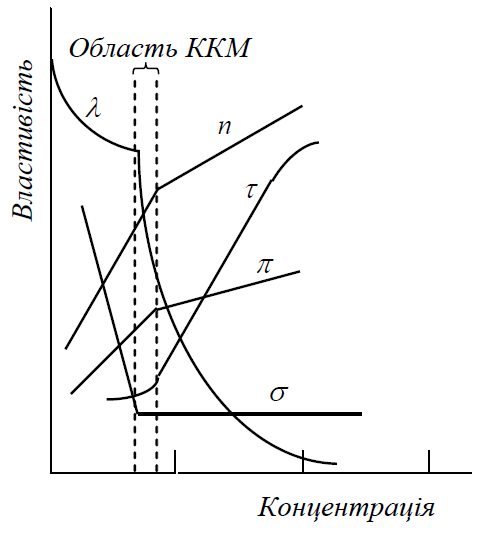
Рис. 1.1 – Залежність властивостей розчинів ПАР від концентрації:
– молярна електрична провідність; n – показник заломлення світла;
– мутність; – осмотичний тиск; – поверхневий натяг
Наявність вигину чи зламу можна пояснити таким чином. При досягненні ККМ введення нових порцій ПАР лише збільшує кількість міцел, концентрація ж мономера залишається незмінною. Тому, наприклад, внесок нових порцій іоногенної ПАР в електричну провідність стає іншим, ніж до ККМ, поверхневий натяг не змінюється (моношар на межі поділу вода – повітря вже заповнений), каламутність же, незначна до досягнення ККМ, починає, навпаки, різко зростати.
Можна вважати, що ККМ – це мінімальна концентрація розчиненої поверхнево-активної речовини, при якій можна експериментально виявити колоїднодисперсну фазу. Згідно з визначенням, прийнятим IUPAC, ККМ – це
порівняно вузький інтервал концентрацій, який вказує межу, нижче за яку міцели практично не виявляються, а вище за яку практично вся ПАР, що додається, утворює міцели. Можна також визначити ККМ як вузький діапазон, в якому залежність багатьох властивостей розчинів ПАР від концентрації зазнає істотних змін. Треба, однак, мати на увазі, що вигин чи злам не завжди відповідають ККМ і не обов’язково говорять про міцелоутворення.
Відомі десятки методів визначення ККМ, і для даної ПАР різні методи при вмілому їх застосуванні дають порівняно близькі значення ККМ. Найбільш поширені методи визначення ККМ, засновані на вимірюванні поверхневого натягу, електричної провідності, густини, показника заломлення, швидкості звуку, осмотичного тиску, пониження температури замерзання води, тиску пари розчинника, мутності, в’язкості, розчинності ПАР, а також на визначенні парціальних мольних об’ємів.
Багато водорозчинних барвників при появі в розчині міцел можуть зв’язуватися ними (зокрема, адсорбуватися на їх поверхні). При цьому, внаслідок зміни ближнього оточення хромофорної системи, може змінитися спектр поглинання або/і флуоресценції. Зміни забарвлення можна фіксувати навіть візуально, що інколи використовується для визначення ККМ.
У свою чергу, нерозчинні у воді барвники можуть “колоїдно розчинятися” лише в присутності міцел; водний розчин ПАР, що знаходиться в контакті з твердою фазою барвника, забарвлюється лише при досягненні ККМ.
Особливо поширене для визначення ККМ використання вимірювань поверхневого натягу (рис. 1.2).
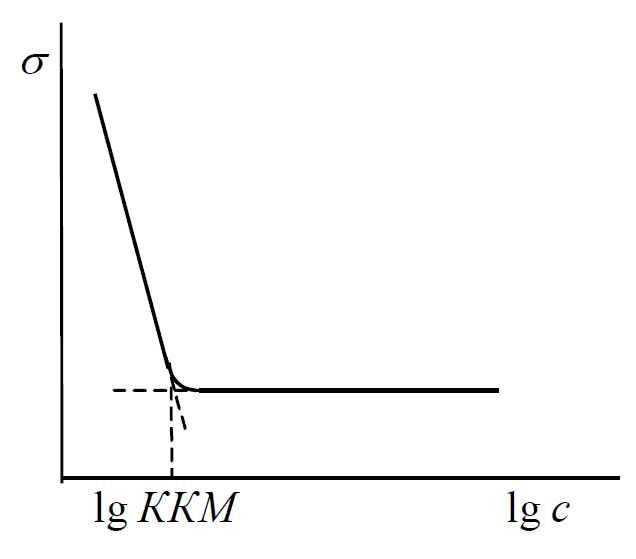
Рис. 1.2 – Залежність поверхневого натягу розчину від логарифма концентрації ПАР
На початковій стадії міцелоутворення, при концентраціях поблизу ККМ, міцели звичайно сферичні і колоїдна система практично монодисперсна. При більш високих концентраціях ПАР можливе зростання міцел і зміна їх форми.
Кількість мономерів ПАР, зв’язаних в асоціат, називається числом агрегації (Nагр). Існує ряд методів експериментальної оцінки значень Nагр. Поширене використання розсіяння світла: визначення мутності при масових (г*дм–3) концентраціях с > ККМ дозволяє оцінити міцелярну масу Mміц за рівнянням Дебая, яке у цьому випадку набуває виду:
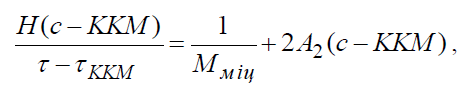

(1.1)
де Н – константа, А2 – другий віріальний коефіцієнт, що характеризує силу взаємодії міцел з розчинником, ТККМ – мутність розчину до ККМ.
Оскільки міцелярна маса є сумою молярної маси всіх складових міцели, то знаючи Mміц, неважко оцінити значення Nагр. Для міцел, що утворюються поблизу ККМ, Nагр звичайно складає від 20 – 30 до 100 – 200, але іноді досягає декількох тисяч.
Для з’ясування причин міцелоутворення розглянемо стан мономерної молекули або іона колоїдної ПАР. Наприклад, для іона н- додецилтриметиламонію довжина вуглеводневого радикала складає 1,7 нм, а об’єм 0,35 нм3. При концентрації нижчій за ККМ бромід додецилтриметиламонію існує у вигляді іонів, оскільки ця іоногенна ПАР, яка є “колоїдним електролітом”, повністю дисоціює. Як уже було сказано в розділі I, навколо довгого вуглеводневого радикала відбувається ущільнення ажурної структури води і створюється “льодоподібна” область (рис. 1.3).
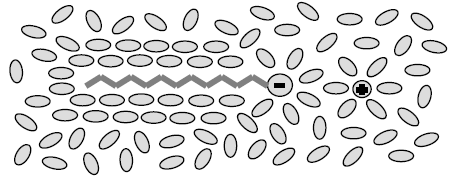
Рис. 1.3 – Мономер іонної ПАР у воді: “льодоподібна” область води
навколо вуглеводного радикала
Дослідження об’ємних властивостей розбавлених розчинів ПАР загалом підтверджують, що гідратація мономерів носить у значній мірі гідрофобний характер, хоча гідратація гідрофільної частини, особливо у разі іонних ПАР, дає свій внесок. Якщо вуглеводневий радикал досить довгий, то стає можливою асоціація мономерів ПАР у міцели, в яких вуглеводневі радикали “сховані” від води і сольватують один одного. Порції ПАР, що додаються, йдуть на утворення нових міцел, а в ряді випадків і на укрупнення вже існуючих.
Отже, рушійною силою утворення надмолекулярних структур (асоціатів ПАР) є прагнення води “позбутися чужорідних тіл”, тобто гідрофобні взаємодії. Виникаюча при цьому міцела являє собою “краплю масла” (вуглеводневі радикали), оточену гідратованою оболонкою з гідрофільних груп. У дисперсійному середовищі концентрація молекулярно розчинених мономерів залишається незмінною; тому значення ККМ може розглядатися як мономерна розчинність.
У разі ПАР, які до асоціації існують у розчині у вигляді окремих іонів, електростатичне відштовхування однойменно заряджених груп унеможливило б існування асоціатів. Однак включення до складу гідрофільної оболонки певної кількості протиіонів (наприклад, іонів Br– у випадку додецилтриметиламонію, іонів Na+ у разі н-додецилсульфату тощо) усуває цю перешкоду. Кількість міцно зв’язаних протиіонів складає від 50 до 90% від кількості іонів ПАР в асоціаті. Таким чином, на поверхні частинок дисперсної фази виникає подвійний електричний шар. Іонні частини ПАР в асоціаті утворюють шар потенціалвизначаючих іонів, міцно пов'язані протиіони – адсорбційний шар, або шар Штерна, а інші протиіони розподілені в дифузній частині гідросфери. Отже, при міцелоутворенні “колоїдних електролітів” відіграють роль і електростатичні взаємодії.
Таким чином, є певна схожість такої структури з ліофобною міцелою (роль агрегату у разі міцел ПАР грає сукупність вуглеводневих “хвостів”). Проте, якщо у разі ліофобних золів міцелою прийнято називати колоїдну частинку (гранулу) разом з її навколишньою дифузною частиною ПЕШ, тобто загалом електрично нейтральне утворення, то в фізико-хімії колоїдних ПАР словом “міцела” частіше означають тільки частинку дисперсної фази – асоціат з іонів ПАР і міцно пов’язаних з ними протиіонів, тобто частинку заряджену. Є дані про значення електрокінетичного потенціалу для міцел іонних ПАР. Звичайно ця величина становить кілька десятків мілівольт.
Істотно, що початок міцелоутворення носить стрибкоподібний характер – до критичної концентрації міцели в розчині не виявляються, а після неї вся ПАР, що додається, йде на утворення міцел. Причина полягає в кооперативному, колективному характері міцелоутворення. Як уже відмічалося, числа агрегації досить великі. Так, для сферичних міцел н-додецилсульфату натрію Nагр = 62 (середнє значення, за даними різних авторів), а для сферичних міцел лаурату, міристату і пальмітату натрію (н-C11H23COONa, н-C13H27COONa, н-C15H31COONa) значення Nагр дорівнюють 50, 95 і 170, відповідно. Системи поблизу ККМ практично монодисперсні, це означає, що при міцелоутворенні відразу ж виникають саме великі асоціати.
Це пояснюється тим, що для оптимального “екранування” довгих вуглеводневих радикалів від води необхідні цілком певні значення Nагр. Доведено, що у деяких випадках утворюються малі передміцелярні асоціати (звичайно димери). Можливість утворення останніх треба враховувати при експериментальному визначенні ККМ, наприклад, методом електричної провідності. Загалом же для подальшого викладу можливо припустити, що до ККМ міцели відсутні зовсім.
З іншого боку, молекули або іони ПАР, що складають міцели, знаходяться в стані динамічної (рухливої) рівноваги з мономерами ПАР у водній фазі. Швидкість обміну іонами між міцелою і водною фазою складає від 10–5 до 10–7 с.
Для опису міцелоутворення запропоновано дві приблизно рівноцінні моделі. Перша заснована на уявленні про міцели як про “псевдофазу”, друга, “квазіхімічна”, трактує міцелоутворення як виникнення великої комплексної частинки:


(1.2)
Застосування закону дії мас дозволяє зв’язати число міцел в одиниці об’єму N, з константою рівноваги міцелоутворення Kміц і рівноважною концентрацією мономерів ПАР в розчині хПАР:


(1.3)
(NA – число Авогадро). Оскільки значення Nагр велике, то в ході міцелоутворення невелике збільшення хПАР призводить до різкого збільшення N, що якісно пояснює вузькість інтервалу концентрацій.
1.3 Різновиди колоїдних ПАР
Існує цілий ряд поверхнево-активних речовин природного походження, з яких передусім потрібно відмітити «мила», тобто солі (звичайно натрієві або калієві) жирних кислот, наприклад, олеат натрію CH3(CH2)7CH=CH(CH2)7COO–Na+. Мила здавна виробляли з природних жирів або масел шляхом їх лужного варива, наприклад:
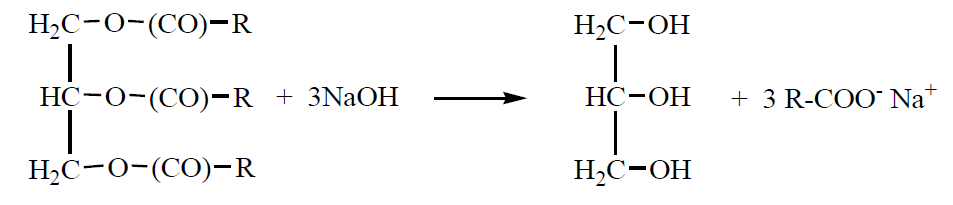

(1.4)
Парафінові або олефінові залишки R містять звичайно від 10 до 20 вуглецевих атомів. Для одержання мила можна використати також технічний стеарин – суміш пальмітинової н-C15H31COOH і стеаринової н-C17H35COOH кислот, які отримують з кокосових горіхів і пальмових зерен. Поверхнево-активні властивості мають також солі нафтенових кислот, що здобувають з нафти. Подібними прийомами була одержана безліч аніонних ПАР, однак, у зв’язку з малою розчинністю кальцієвих і магнієвих солей вищих кислот, застосовність таких ПАР обмежена. Тому більше поширення отримали продукти сульфування вуглеводнів, передусім алкілсульфонати, алкіларилсульфонати та алкілсульфати.
Нарівні з найменуваннями за Женевською номенклатурою прийняті також тривіальні назви ПАР. Так, дуже поширений у наукових дослідженнях і для прикладних цілей н-додецилсульфат натрію н-C12H25OSO3–Na+ часто називають лаурилсульфатом натрію. Спеціальні назви особливо характерні для вищих карбонових кислот з парним числом атомів вуглецю (або з непарним числом, якщо не враховувати групи COOH). Це пов’язано з їх поширеністю в жирах і маслах тваринного та рослинного походження.
З аніонних ПАР відомі також тіосульфати, фосфати, солі жовчних кислот (наприклад, холат натрію) й інші сполуки.
У наш час синтезована величезна кількість катіонних ПАР, головним чином четвертинних амонієвих солей, таких, як згадуваний н-додецилтриметиламоній бромід, або, наприклад, цетилтриметиламоній бромід н-C16H33N(CH2)3+Br–, а також ПАР на основі піридинієвих солей і четвертинних фосфонієвих солей.
Крім цих двох класів ПАР (аніонних і катіонних) відомий найбільш величезний клас неіонних, або неіоногенних ПАР. Їх гідрофільними частинами є не компактні іонні угрупування, а електронейтральні оксиетиленові ланцюжки:

(1.5)
–(CH2–CH2–O–CH2–CH2–O–CH2–CH2–O–CH2–CH2–O)–
У розчині ці ланцюжки утворюють клубки, зв’язуючи молекули води. Гідратація здійснюється за рахунок водневих зв’язків (неподілені електронні пари атомів кисню); можливість конформацій оксиетиленового олігомера зумовлює також і ентропійний чинник гідрофільності ланцюжка.
Неіонні ПАР є звичайно поліоксиетиленовими похідними спо- лук з довгими вуглеводневими радикалами, наприклад,
кислот н-CnH2n+1(CO)O–(CH2CH2O)mH,
спиртів н-CnH2n+1O–(CH2CH2O)mH,
метилові ефіри оксиетильованих кислот або спиртів н- CnH2n+1(CO)O–(CH2CH2O)mCH3,
о
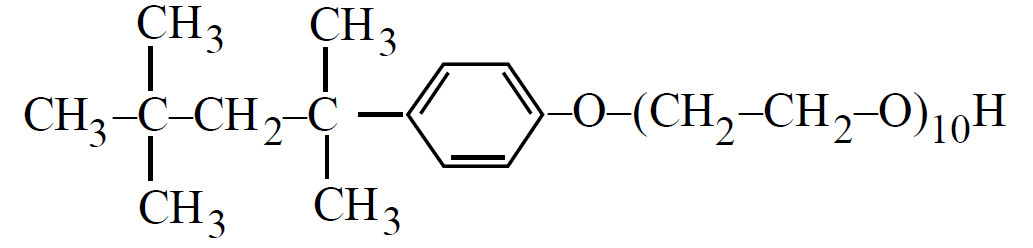 ксиетильовані алкіл феноли
ксиетильовані алкіл феноли
(1.6)
Синтез неіонних ПАР здійснюється шляхом оксиетилювання:
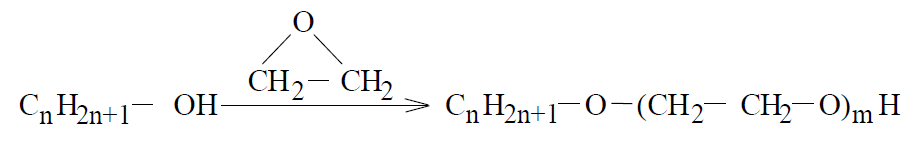

(1.7)
тому їх іноді називають “продуктами” оксиду етилену. Такі препарати, як правило, є сумішшю гомологів з різним значенням m. Тому ступінь наближеності кожного з препаратів до індивідуальної речовини залежить від способу очищення.
Значення ККМ є найважливішою характеристикою ПАР. Цей параметр залежить від природи полярної групи і від будови, передусім від довжини вуглеводневого радикала. У довідковій літературі наводиться декілька тисяч значень ККМ.
1.4 Будова міцел ПАР
На початковій стадії міцелоутворення у водному розчині поблизу ККМ звичайно утворюються сферичні міцели однакових розмірів.
На рис. 1.4 наведена схема будови типової міцели на прикладі аніонної ПАР; наявність поверхневого заряду забезпечує хорошу гідратацію міцел.
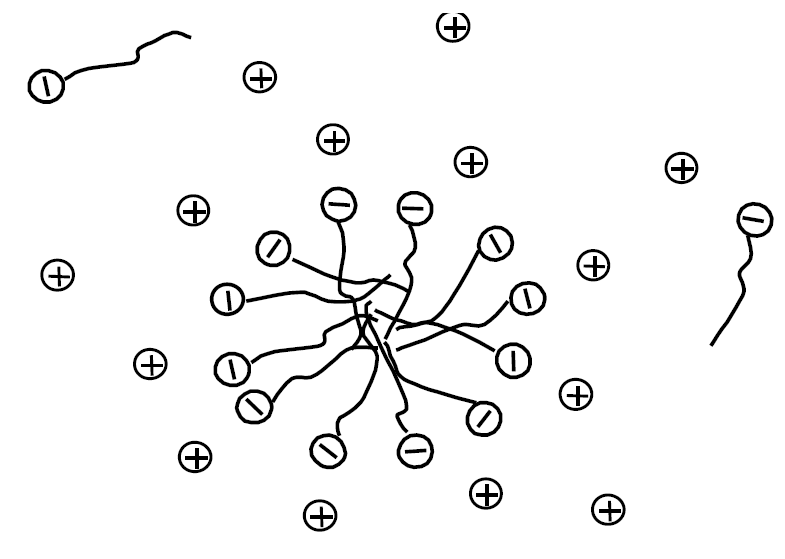
Рис. 1.4 – Структура міцели іонної ПАР у воді
Товщина щільної частини ПЕШ (області Штерна) складає частки нанометрів, дифузна частина ПЕШ тягнеться углиб безперервної водної фази на десятки нанометрів. Введення в розчин електролітів (наприклад, NaCl) призводить, відповідно теорії ПЕШ, до стиснення дифузної частини. Якщо електроліт, що додається в систему, містить протиіони іншого типу (наприклад, у разі міцел н-додецилсульфату натрію – іони Н+, Li+, Ca2+, Cu2+, N(CH3)4+ тощо), то поряд зі стисненням дифузної області ПЕШ встановлюється іонообмінна рівновага в адсорбційному шарі, причому частка того або іншого протиіона від загальної кількості щільно пов’язаних іонів визначається його місцем у стандартному ліотропному ряду.
Класична модель Хартлі трактує міцелу колоїдної ПАР як “сферичну краплю масла” в гідрофільній оболонці. Але це справедливо лише в першому наближенні. Хоча рідким вуглеводням взагалі властива деяка впорядкованість, рідкий стан внутрішньої частини міцели, утвореної вуглеводневими радикалами, відрізняється від стану об’ємної рідкої фази, характерного, наприклад, для краплі емульсії. Завдяки орієнтації полярних груп вуглеводневі хвости частково фіксовані, і вся міцела знаходиться в рідкокристалічному стані, подібно рідким плівкам.
В
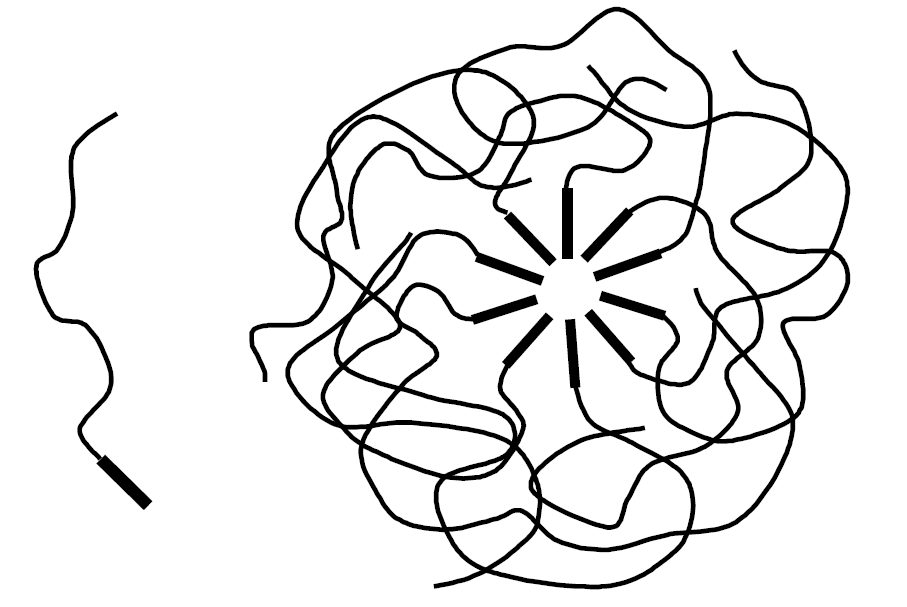 ластивості міцелярних розчинів колоїдних ПАР добре пояснює “блокова” модель П. Фромхерца (1981), згідно з якою “миттєва картина” міцели іонної ПАР – щільноупакований куб, зібраний з блоків, причому вуглеводневі частини в певній мірі контактують з водою. Внаслідок усереднення у часі обертання і рухів складаючих міцелу частин вона в ході експериментальних досліджень проявляє себе як сферична частинка. Ядро ж не є абсолютно “сухим”, тобто збезводненим. Як результат, затвердилося уявлення про міцели як про сильно розупорядковані і гідратовані пористі кластери. Схема будови сферичної міцели неіонної ПАР наведена на рис. 1.5.
ластивості міцелярних розчинів колоїдних ПАР добре пояснює “блокова” модель П. Фромхерца (1981), згідно з якою “миттєва картина” міцели іонної ПАР – щільноупакований куб, зібраний з блоків, причому вуглеводневі частини в певній мірі контактують з водою. Внаслідок усереднення у часі обертання і рухів складаючих міцелу частин вона в ході експериментальних досліджень проявляє себе як сферична частинка. Ядро ж не є абсолютно “сухим”, тобто збезводненим. Як результат, затвердилося уявлення про міцели як про сильно розупорядковані і гідратовані пористі кластери. Схема будови сферичної міцели неіонної ПАР наведена на рис. 1.5. Рис. 1.5 – Структура міцели неіонної ПАР
Вуглеводневі радикали розташовані радіально, а гідрофільна частина являє собою “мантію” із сильно скручених оксиетиленових ланцюжків
(–CH2–CH2–О–)m.
Переплетення і скручування оксиетиленових ланцюжків найбільше вигідно для взаємодії з молекулами води, передусім за рахунок водневих зв’язків, утворених атомами водню води з атомами кисню оксиетиленового ланцюжка.
Експериментально доведено, що форма міцел колоїдних ПАР буває не тільки сферичною. Легко уявити собі, що починаючи з певних розмірів сферичні міцели вже неможливі, оскільки полярні групи будуть входити у внутрішню вуглеводневу частину міцели. Розрізняють три основні типи міцел:
– сферичні міцели (“міцели Хартлі”, рис. 1.6, a);
– пластинчаті і дископодібні міцели (“міцели МакБена”, рис.1.6, б);
– паличкоподібні, або стержнеподібні, або циліндричні міцели (“міцели Дебая”, рис. 1.6, в).
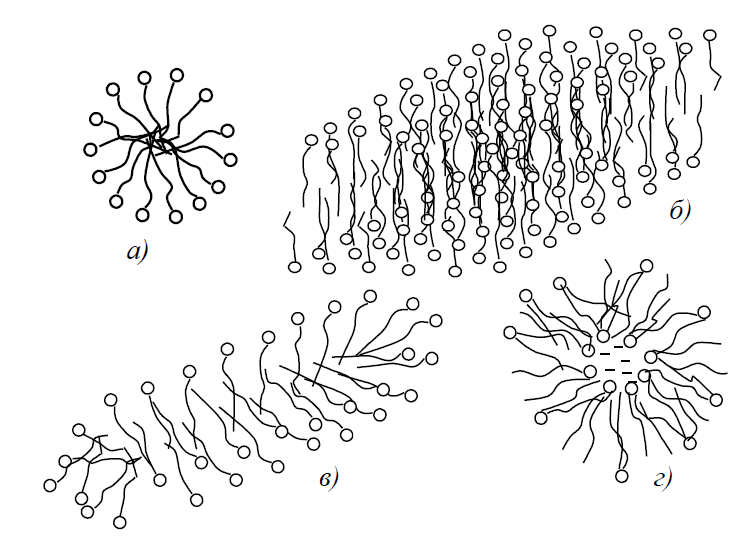
Рис. 1.6 – Різні типи міцелярних структур
Крім трьох основних типів існує і ряд проміжних. Всі ці типи міцел є різновидами надмолекулярних структур, результатом гідрофобної взаємодії.
Існування анізометричних міцел доведено багатьма методами, в тому числі рентгенографічним, оптичним, реологічним, кондуктометричним і іншими. Так, пластинчаті міцели були ідентифіковані головним чином за даними про дифракцію рентгенівських променів, паличкоподібні – на основі даних про розсіяння світла, еліпсоїдальні – з дослідження подвійного луче-заломлення. Широко застосовуються малокутове розсіяння нейтронів і електронна мікроскопія швидкозаморожених розчинів.
Циліндричні і пластинчаті міцели являють собою відповідно одновимірнопротяжні і двовимірнопротяжні колоїдно-хімічні об’єкти. Вони можуть, в принципі, розростатися в довжину (а пластинчаті навіть за двома вимірюваннями), у чому їх відмінність від сферичних міцел, для яких значення Nагр обмежені.
Пластинчаста міцела являє собою подвійний шар (бішар, або “ламелу”, тобто пластинчасту структуру) молекул або іонів ПАР, орієнтованих гідрофільними частинами у водну фазу. Згинаючись, анізометричні міцели в розчині стають “червоподібними” або “стрічковими”. Бішар може також згортатися, перетворюючись в так звану “везикулу”, структуру, всередині якої зберігається вода (рис. 1.6, г).
Різні типи міцел характерні, по-перше, для різних типів ПАР. Добре відомо, що внаслідок структурних обмежень для ПАР з двома вуглеводневими хвостами переважає ламелярна структура асоціатів і виникнення везикул. По-друге, одна і та ж ПАР під впливом різних чинників може утворювати міцели різної форми, що дозволяє говорити про поліморфізм міцел. Взагалі кажучи, словом “поліморфізм” (грецькою “різноманіття”) зараз прийнято позначати здатність твердих тіл або рідких кристалів існувати в декількох формах з різною кристалічною структурою і властивостями при одному і тому ж хімічному складі; взаємоперетворення між такими поліморфними модифікаціями називаються поліморфними переходами.
Головним чинником, який сприяє перетворенню сферичних міцел в анізометричні, є концентрація ПАР. Для іонних ПАР характер поліморфних переходів дуже сильно залежить як від природи протиіона, так і від добавок електролітів. Останні часто сприяють утворенню стержнеподібних міцел Дебая. Особливо різкі зміни спостерігаються при добавках до розчинів катіонних ПАР органічних протиіонів (наприклад, саліцилату, тозилату й інш.): розчини стають настільки структурованими вже при концентраціях ПАР = 10–3 моль*дм–3, що не витікають з колби при її перевертанні.
Поліморфізм міцел дуже сильно позначається на в’язкості розчинів, тому віскозиметрія широко застосовується для з’ясування форми колоїдних частинок.
Однією з причин перетворення сферичних міцел в еліпсоїдальні, стержнеподібні, червоподібні, пластинчаті, стрічкові й інші структури з явно вираженою асиметрією є взаємодія (відштовхування) дифузних частин подвійних електричних шарів: при подальшому збереженні сферичної форми міцел їх ПЕШ перекривалися б дуже сильно. Крім того, завдяки когезійним взаємодіям в одновимірно- і двовимірнопротяжних структурах вуглеводневі ланцюги розташовуються паралельно один одному, тобто більш впорядковано, ніж у сферичних міцелах. Така компактність створює можливості для розчинення нових порцій ПАР.
1.5 Явище солюбілізації
Важливою властивістю міцелярних розчинів ПАР у воді є їх здатність до солюбілізації (колоїдного розчинення) практично нерозчинних у воді речовин.
Солюбілізацією називається самочинне розчинення міцелярною фазою ПАР речовин (твердих, рідких і газоподібних), мало розчинних у звичайних умовах у дисперсійному середовищі, з утворенням термодинамічно стабільного ізотропного розчину. Наприклад, розчинність октану у воді дуже мала (всього 0,0015%), але в 10%-ному розчині олеату натрію вона зростає в тисячу разів. Розчинність багатьох газів, у тому числі О2 і CO2, у міцелярних розчинах ПАР помітно вища, ніж у воді.
Солюбілізація відбувається в тому випадку, коли в розчині є міцели (сПАР > ККМ). Колоїдна ПАР у цьому випадку називається солюбілізатором, а колоїдно-розчинена речовина – солюбілізатом. Міцелярні розчини колоїдних ПАР добре солюбілізують бензол, гептан, мінеральні масла, гас і інші малополярні органічні сполуки та їх суміші, в тому числі маслорозчинні (жиророзчинні) азосполуки, наприклад, азобензол і барвник судан III:


(1.8)
Розчин ПАР при контакті з барвником забарвлюється, коли сПАР перевищує ККМ.
У залежності від природи солюбілізатів реалізуються різні способи розташування їх всередині міцели, схематично зображені на рис. 1.7. Аліфатичні солюбілізати розташовуються всередині “масляної краплі”, в області вуглеводневих “хвостів”, ароматичні – як всередині міцел, так і поблизу поверхні.
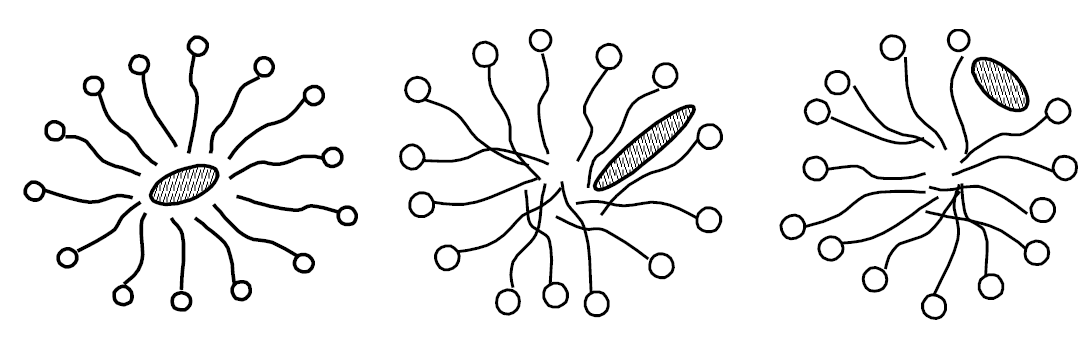
Рис. 1.7 – Варіанти розташування солюбілізатів всередині міцел
Потрібно відрізняти солюбілізацію від інших явищ, зовні на неї схожих – від гідротропії і від диспергування. Гідротропією називається збільшення розчинності різних речовин у воді внаслідок додання до останньої гідротропів – речовин, що змінюють її структуру. Гідротропами є, наприклад, деякі сульфоароматичні сполуки, карбамід та інші. Іноді до гідротропів відносять речовини, які утворюють з малорозчинними речовинами розчинні у воді продукти.
У ході диспергування (емульгування чи суспендування) поверхнево-активні речовини, адсорбуючись на поверхні крапельок масла або частинок суспензії, знижують міжфазний натяг і стабілізують гідрофобні дисперсії.
Солюбілізація є однією з ланок обміну речовин у живих організмах. Нарівні з солюбілізацією важливу роль у живленні людини та тварин відіграють гідротропна і диспергуюча дії ПАР у водному середовищі по відношенню до жирів. Вирішальне значення у засвоєнні жирів мають найбільш типові біологічні ПАР – хольові кислоти, що містяться в жовчі.
Солюбілізація широко застосовується у фармації. Для цієї мети особливо зручні неіоногенні ПАР, багато з яких цілком безпечні для організму. Вони використовуються для солюбілізації вітамінів, масел, барбітуратів, аспірину, що дозволяє створити різні форми цих і багатьох інших лікувальних препаратів, які добре засвоюються організмом. У міцелах таких ПАР різні солюбілізати, в міру своєї гідрофобності, займають місце або виключно в гідрофобному вуглеводневому ядрі, або в гідрофільній оксиетиленовій частині, або в проміжній області.
Іншим явищем, родинним солюбілізації, є зв’язування різних водорозчинних сполук міцелами колоїдних ПАР. Таке зв’язування може зрештою призводити до утворення змішаних міцел.
Бензол, толуол, гексан, октан і інші вуглеводневі розчинники солюбілізуються міцелами ПАР досить добре, і “набряклі” міцели завдяки масляній “начинці” вже починають нагадувати емульсії. Такі дисперсії, все ще ліофільні, називають мікроемульсіями. Термодинамічна стійкість їх досягається за рахунок великої кількості ПАР; оптимальним є використання суміші ПАР зі спиртами, обмежено розчинними у воді (бутанолом, пентанолом тощо). Розміри сферичних частинок таких мікроемульсій звичайно на порядок більші за розміри сферичних міцел ПАР.
Міцели колоїдних ПАР, а також краплі мікроемульсій можуть впливати на перебіг різних хімічних реакцій. Однією з областей застосування колоїдних ПАР є так званий міцелярний каталіз. При цьому важливу роль відіграє відносна дешевизна найбільш вжиткових ПАР, оскільки в багатьох випадках кількість ПАР, що необхідна для прискорення різних реакцій, набагато менша, ніж кіль кість необхідного для тієї ж мети органічного розчинника, що дорого коштує (наприклад, диметилсульфоксиду, диметилформаміду або ацетонітрилу). Явище міцелярного каталізу зумовлене зміною концентрацій субстрату і реагентів внаслідок зв’язування їх міцелами (концентрування), а також впливом міцел на константи швидкості та рівноваги, внаслідок зміни мікрооточення реагентів у порівнянні з водною фазою. Константи швидкості деяких реакцій збільшуються в тисячі разів. Звичайно реакції перебігають на поверхні міцел.
2. ЗАСТОСУВАННЯ КОЛОЇДНИХ ПАР
2.1 Миюча дія колоїдних ПАР
Найважливішою областю застосування колоїдних ПАР є використання їх як миючих засобів.
Звичайні забруднення, що осідають на поверхні волокон тканин – це багатокомпонентна суміш рідких (маслянистих) і/або твердих (пил, кіптява) речовин, які утворюють іноді сильно структуровану систему. У зв’язку з цим стає зрозумілим, чому відмивання забруднених тканин навіть при нагріванні і механічному впливі здійснюється з великими труднощами, якщо не застосовувати миючих засобів.
Як такі засоби (детергенти) використовуються передусім вже згадувані мила – натрієві і калієві солі жирних карбонових кислот (наприклад, CnH2n+1COONa) та інші аніонні ПАР того ж типу. Однак, у зв’язку з тим, що в кислому середовищі ці солі перетворюються в малорозчинні карбонові кислоти, а в жорсткій воді в осад випадають кальцієві і магнієві солі карбонових кислот, більш універсальними й ефективними засобами для прання виявилися алкілсульфати і алкілсульфонати, що складають основу пральних порошків.
Практика показала, що хорошими детергентами є сполуки з 10–18 атомами C у вуглеводневому радикалі, тобто саме ті ПАР, яким властива висока поверхнева активність і здатність до міцелоутворення (за П. О. Ребіндером, “повноцінні ПАР”). При цьому взаємозв’язок поверхневих і об’ємних властивостей у розчинах цих ПАР такий, що значення максимальної адсорбції Гмакс на межі поділу вода – повітря часто досягаються вже при концентраціях, що становлять всього 10 – 30% від значення ККМ.

(2.1)
Для відриву масляної краплі від твердої поверхні, тобто для утворення вільної твердої поверхні, повинна виконуватися умова G0, що відповідає співвідношенню:
м/в + т/в – т/м 0
Розглянемо основні чинники, які забезпечують миючу дію таких ПАР.
1. Важливою умовою відмивання тканин є хороше змочування їх поверхонь миючою рідиною, і, зокрема, проникнення води в тонкі капіляри. Це досягається зниженням поверхневого натягу води (звичайно на 30 – 40 мДж*м–2) при доданні ПАР.
2. Молекули (іони) мила, адсорбуючись на поверхні волокна і на твердих і рідких частинках забруднень, формують добре гідратований адсорбційний шар. Це створює передумови для відриву від поверхні волокна частинок забруднень і подальшого їх дроблення. При цьому вибіркове змочування волокон тканини призводить до “відтиснення” масляних забруднень з поверхні, що очищується.
3. Диспергуюча дія ПАР зводиться до придання агрегативної стійкості твердим і рідким (масляним) частинкам забруднень, тобто до суспендування або емульгування. ПАР, що знаходиться в розчині, адсорбується на тих частинках, які вже відірвалися від поверхні тканини, і виникаючі адсорбційні шари утруднюють повторне прилипання частинок до поверхні волокна.
У свою чергу, ліофілізація поверхні, що відмивається, перешкоджає ресорбції забруднень.
4. Іонні колоїдні ПАР є могутніми піноутворювачами, що стабілізують піну. Пінення ж сприяє як механічному витисненню, так і флотації забруднень.
5. Імовірно, що забруднення масляного характеру можуть солюбілізуватися всередині міцел ПАР. Така точка зору природна, оскільки миюча дія спостерігається лише при концентраціях понад ККМ. Висловлювалася думка, що солюбілізація і є головним чинником миючої дії ПАР.
Втім, при подальшому підвищенні концентрації ПАР понад ККМ практично не спостерігається посилення миючої дії, і це до зволяє вважати, що остання визначається лише концентрацією мономерів, а міцели відіграють роль “депо” ПАР, відшкодовуючи спад мономерів ПАР, що витрачаються на змочування, диспергування, піноутворення тощо.
Як бачимо, хоча механізми миючої дії різноманітні, але всі вони зумовлені високою поверхневою активністю колоїдних ПАР, що виявляється у високій адсорбційній здатності, а також діфільністю, що створює умови для міцелоутворення.
У синтетичних миючих засобах, що застосовуються на практиці, вміст ПАР складає менше за половину маси. В основному це алкілсульфати, а також неіонні ПАР (оксиетильовані спирти) і невелика кількість алкіламінів. У таких системах утворюються змішані міцели, що складаються з ПАР різних типів. Іншу частину маси складають різні добавки, які поліпшують миючий вплив колоїдних ПАР. Для пом’якшення води додається поліфосфат натрію, який зв’язує іони Ca2+ і Mg2+, а також стабілізує частинки забруднень. Буферна суміш із карбонату і силікату натрію дозволяє регулювати pH, що впливає на набухання волокон тканин. При пранні шерстяних тканин оптимальне значення pH = 7 – 8, а при пранні бавовняних тканин рН = 9 – 10. Застосовуються також добавки сульфату натрію і бентонітових глин (останні ще в давнині самі по собі вживалися як миючий засіб); карбоксиметлцелюлоза забезпечує ліофілізацію поверхонь. У деяких випадках додаються спеціальні відбілюючі реагенти, а ферменти вводяться у мікрокапсульованому стані з метою гідролізу білкових забруднень.
Склад тих або інших миючих засобів визначається передусім цілями відмивання. Так, знежирення поверхні, яка очищається, небажане, якщо мова йде про косметичні мила. Інший приклад: хоча надлишок неіонних ПАР знижує піноутворення, особливо при нагріві (коли дегідратація оксиетиленових ланцюжків веде до дестабілізації міцел), подібні склади миючих засобів оптимальні для застосування в автоматичних пральних машинах, де зайва піна небажана.
Шампуні, що випускаються промисловістю, мають різні склади – в залежності від властивостей волосся, для відмивання яких вони рекомендуються.
У техніці застосовуються різноманітні спеціальні склади, на приклад, для відмивання двигунів від забруднень, масла і нагару, для відмивання твердих поверхонь різних типів. Для технічних цілей ПАР можуть застосовуватися при pH понад 11, іноді – в суміші з органічними розчинниками.
Катіонні ПАР використовуються як ефективні бактерицидні засоби, наприклад, для відмивання казанів і інших ємкостей на підприємствах громадського харчування, для дезінфекції лікарняних приміщень тощо.
Синтетичні миючі засоби випускаються промисловістю у вигляді порошків, рідин або паст.
2.2 Інші області застосування колоїдних ПАР
Приготування миючих засобів є важливою, але далеко не єдиною областю застосування колоїдних ПАР. Адсорбуючись на межах поділу фаз, ПАР модифікують їх. На цьому засновано застосування ПАР у різних процесах, приклади яких наведені далі.
Диспергування твердих тіл полегшується в присутності ПАР (ефект Ребіндера, що полягає в адсорбційному зниженні міцності твердих тіл).
ПАР застосовують для стабілізації золів, суспензій, а також пін і емульсій (в останньому випадку кількісним критерієм служать числа ГЛБ).
Ті ж колоїдні ПАР, які виявляють найбільшу миючу дію, тобто з числом атомів вуглецю в радикалі n = 10–18, є найбільш типовими і цінними як флотоагенти та стабілізатори.
За допомогою ПАР регулюють змочування твердих поверхонь, зокрема, поліпшують або погіршують змочування поверхонь водою (ліофілізація або ліофобізація, відповідно).
Регулювання структуроутворення в дисперсних системах також проводиться за допомогою ПАР.
У всіх вказаних випадках адсорбція веде до формування поверхневих шарів, а інколи і до зміни поверхневого заряду. Тому розглянемо деякі особливості адсорбції колоїдних ПАР на різних міжфазних межах.
Адсорбція колоїдних ПАР на межі поділу вода – масло є хорошою ілюстрацією правила зрівнювання полярності фаз Ребіндера.
Загалом, все різноманіття застосувань колоїдних ПАР здебільшого зводиться до впливу на властивості поверхневих міжфазних шарів – і тим самим до впливу на процеси, що відбуваються на межі поділу фаз.
Головними споживачами ПАР є:
– гірничодобувна і переробна промисловість (пониження міцності при дробленні, підвищення віддачі нафтових пластів, флотаційне збагачення);
– металообробна промисловість і транспорт (мастила і мастильно-охолоджуючі рідини, зниження зносу твердих поверхонь, що труться, шляхом зменшення тертя між ними, зниження міцності при різанні, захист металів від корозії);
– текстильна промисловість (ПАР використовуються майже на всіх стадіях виробництва тканин);
– будівельна індустрія (високоефективні добавки для збільшення пластичності керамічних композицій, поліпшення адгезії між наповнювачем і зв’язуючим).
Широко застосовуються колоїдні ПАР у виробництві штучного каучуку (емульсійна полімеризація), у лакофарбній, харчовій, фармацевтичній і парфумерній промисловостях, у поліграфії, при пожежогасінні (для піноутворення).
Виключно важливі колоїдні ПАР і родинні їм сполуки для біотехнології, хроматографії, синтезу наночастинок.
Прагнення підвищити ефективність застосування ПАР приводить до розширення їх асортименту. Так, кремнійорганічні і інші елементоорганічні ПАР мають підвищену термостійкість, а фторовані ПАР більш різко знижують поверхневий натяг, ніж звичайні вуглеводневі ПАР. Як інгібітори корозії найбільш ефективні катіонні ПАР.
В останні десятиріччя стали широко застосовуватися блоксополімери оксиду етилену (–CH2–CH2–O–) і оксиду пропілену (– C(CH3)H–CH2–O–), так звані плюроніки (М 103 – 5*103). “Штучна кров” являє собою мікроемульсію фторовуглеців, стабілізовану плюроніками.
Іноді корисні властивості сумішей колоїдних ПАР значно перевершують властивості індивідуальних сполук. Це явище, яке прийнято означати терміном “синергізм”, звичайно пов’язане з утворенням змішаних міцел або змішаних адсорбційних шарів.
У деяких випадках ефективні ПАР, у молекулах яких сполучені структурні елементи, характерні для різних класів. Так, широке поширення знаходять ПАР типу CnH2n+1–O–(CH2CH2O)m–SO3-Na+. Вимоги, що пред’являються до чистоти й індивідуальності ПАР, залежать від їх призначення. Так, у промисловості будівельних матеріалів широко застосовуються добавки поверхнево-активних пластифікаторів до цементних розчинів і бетонів. Зокрема, пластифікатор, утворюючи адсорбційні шари на поверхні цементних частинок, утруднює їх злипання і тим самим збільшує рухливість цементного тіста, сприяє рівномірному перемішуванню, а після затвердіння – підвищенню якості бетону. Для цих цілей з успіхом використовуються не індивідуальні сполуки, а концентрати так званої сульфітно-спиртової барди – продукту з відходів целюлозно-паперової промисловості, що залишається після відгонки спирту зі зброженого сульфітцелюлозного екстракту.
При роботі з колоїдними ПАР необхідно пам’ятати про шкідливий вплив, який вони можуть виявити при дії на шкіру і на органи дихання.
Необхідно, щоб ПАР, які пропонуються для використання у великих масштабах, і супутні їм компоненти мали високе біорозкладання, щоб запобігти нанесенню втрат навколишньому середовищу. Так, виявилося, що поліфосфат натрію, який додається у синтетичні миючі засоби для зм’якшення води і придання агрегативної стійкості частинкам забруднень, сприяє розмноженню у водоймищах синьозелених водоростей. Катіонні ПАР є загалом більш токсичними, ніж аніонні і неіоногенні. У всіх випадках повільніше розкладаються ПАР з розгалуженими вуглеводневими радикалами, ніж з лінійними.
Цікавою областю застосування ПАР є мікрокапсулювання. Мікрокапсулювання різних речовин – це покриття дрібних частинок порошку або крапель тонким шаром непроникної або обмежено проникної захисної оболонки. Явище засноване на здатності ненасичених ПАР до полімеризації; плівки, утворені ВМС, у певному значенні близькі до мембран кліток. Шляхи мікрокапсулювання – адсорбція ВМС на поверхні або коацервація. Потім плівки обробляються дубителем при певній температурі і pH, для надання твердоподібних властивостей. Для створення таких плівок використовуються желатин, альбумін, полівініловий спирт, полісахариди, похідні целюлози. Мікрокапсулювання застосовується у фармації, сільському господарстві, а також використовується для зберігання рідкого палива в брикетах.
ВИСНОВКИ
В курсовій роботі було розглянуто загальну характеристику колоїдних поверхнево-активних речовин. Визначено, що за властивістю дисоціювати ПАР розділяють на іоногенні та неіоногенні. Вказано, що важливою характеристикою колоїдних ПАР є співвідношення гідрофільних і гідрофобних властивостей, яке визначається числом ГЛБ.
Було визначено, що утворення міцел відбувається при певній концентрації – так званій критичній концентрації міцелоутворення (ККМ) – це концентрація ПАР, при якій в його розчині виникає велике число міцел, що перебувають в термодинамічній рівновазі з молекулами (іонами), і різко змінюється ряд властивостей розчинів. Вказано, що значення ККМ є найважливішою характеристикою ПАР. Цей параметр залежить від природи полярної групи і від будови, передусім від довжини вуглеводневого радикала.
В роботі також було відзначено, що застосування колоїдних ПАР пов'язане з їх високою поверхневою активністю, здатністю до змочування, емульгуючою дією, солюбілізацією, здатністю до гелеутворення. В багатьох випадках ефективність їх застосування визначається кількома факторами одночасно. Наприклад, миюча дія пов'язана із здатністю колоїдних ПАР змочувати тканини, зменшувати міжфазний натяг, утворювати міцні адсорбційні шари, солюбілізувати жирові забруднення.
Найважливішою областю застосування колоїдних ПАР є використання їх як миючих засобів, проте прагнення підвищити ефективність застосування ПАР приводить до розширення їх асортименту та появу нових областей застосування.
ПЕРЕЛІК ПОСИЛАНЬ
Мчедлов-Петросян М.О. Колоїдна хімія: підручник / М.О. Мчедлов-Петросян, В.І. Лебідь, О.М. Глазкова, О.В. Лебідь; за ред. проф. М.О. Мчедлова-Петросяна. – 2-ге вид., випр. і доп. – Харків: ХНУ імені В.Н. Каразіна, 2012. – 500 с.