
Факультет – хімічний
Кафедра – харчових технологій
Спеціальність – хімія
Дисципліна – Синтез хімічних речовин
Курс – I
Викладач – доцент Шевченко Л.В.
Лекція на тему : Основи теорії неорганічного синтезу
Для того, щоб виявити тип процесу неорганічного синтезу, нееобхідно доббре ознайомитись з факторами, які виявляють можливість перебігу реакції та швидкість хімічних реакцій в різних фазах.
Розглянемо в загальній фопмі критерії самовільного перебігу процесів та рівноваги системи при визначених умовах її існування.
| Умови існування системи | Критерії самовільного перебігу процесу | Критерії рівноваги системи |
| Ізольована система ( U = const, v= const, m= const ) | Збільшення ентропії S, dS› 0 | Максимум ентропії, dS=0 , d2S ‹0 |
| Ізотермічна система при постійному об’ємі ( Т= const, v= const) | Зменшення енергії Гельмгольца ( ізохорно-ізотермічний потенціал) F, dF‹0 | Мінімум енергії Гел ьмгольца dF =0, d2F› 0 |
| Ізотермічна система при постійному тиску ( Т= const, р= const) | Зменшення енергії Гіббса( ізобарно-ізотермічний потенціал) G, dG‹0 | Мінімум енергії Гіббса dG =0 , d2G› 0 |
Класифікація реакцій по методам синтезу. Вибір методу синтезу.
Реакції у водних розчинах.
Реакції у неводних середовищах.
Реакції у твердій фазі.
Реакції у газовій фазі.
Електрохімічний синтез.
Синтез в розчинах
Розчин – це гомогенна система, яка складається з розчинника і розчиненої речовини. За фазовим станом розчини поділяються на газоподібні, рідкі та тверді. Крім цього, розрізняють розчини водні і неводні, іонні і молекулярні, концентровані і розведені та ін. Важливою характеристикою розчину є його склад. Якщо молекулярні або іонні частинки, розподілені в рідкому розчині, присутні в такій кількості, що за даних умов не відбувається подальшого розчинення речовини, розчин називається насиченим. Наприклад, якщо додати 50 г хлориду натрію NaCl до 100 г води, то при кімнатній температурі розчиниться тільки 36 г солі. Якщо при кімнатній температурі додати до води менше 36 г солі, ми одержимо ненасичений розчин. При нагріванні солі до 1000С може розчинитись 39,8 г NaCl. При обережному охолодженні надлишок солі може не випасти в осад, і ми одержимо перенасичений розчин. Гранична розчинність багатьох речовин у воді при даній температурі є кількісною характеристикою розчинності і наведена в таблицях. Вона визначена в грамах речовини на 100 г розчинника при різних температурах. При охолодженні розчину розчинність зменшується, і зайва сіль випадає в осад. Масу солі m, яка утворила осад, можна обчислити за формулою
m = mрозчину (mt2 – mt1) / (100 + mt2).
Приклад 1. Є насичений при 400С розчин нітрату калію масою 330 г. Скільки грамів солі викристалізується, якщо розчин охолодити до 300С?
Розв’язання. За таблицею розчинності знаходимо, що розчинність KNO3 при 400 - 62 г, при 300 – 45 г. За формулою обчислюємо, скільки солі випало в осад:
m = mрозч. (mt2 – mt1) / (100 + mt2) = 330 г (62 г – 45 г) / (100 + 62) г =
= 330 г17 г / 162 г = 34,6 г.
Концентрація розчинів.
Існують різні способи виразу складу розчину. Найчастіше використовують масову частку розчиненої речовини ω и молярну концентрацію СМ.
Масова частка розчиненої речовини ω – це безрозмірна величина, яка дорівнює відношенню маси розчиненої речовини до загальної маси розчину. Масову частку на практиці виражають в долях одиниці або у відсотках (%). Наприклад, масова частка розчиненої речовини – хлориду кальцію у воді дорівнює 0,1 або 10% (0,1 100% = 10%). Це означа, що в розчині масою 100 г міститься 10 г СаСl2 і 90 г води.
Масову частку розчиненої речовини ω можна обчислити за формулою
ω = mр.р. 100% / mрозчину = mр.р. 100% / (mр.р.+ mH2O) =
= mр.р. 100% / Vρ,
де mр.р. – маса розчиненої речовини, г; m - маса розчину, г. Якщо даний об’єм розчину, то його масу можна обчислити за допомогою густини ρ: ρ = m/V (г/мл); mрозчину = Vρ.
Приклад 2. Яку масу хлориду натрію m(NaCl) і води m(H2O) необхідно взяти, щоб приготувати mрозчину = 500 г з масовою концентрацією ω = 2%?
Розв’язання. Обчислюємо за формулою:
ω = mр.р. 100% / (mр.р.+ mН2О).
ω = mNaCl100% / mNaCl + mH2O ; 2 = х100 / 500;
х = 2500 / 100 = 10 г NaCl.
m(H2O) = 500 г – 10 г = 490 г .
Для приготування 500 г 2%-го розчину необхідно взяти 10 г солі і розчинити в 490 г ( або 490 мл) води.
Якщо змішують два розчини з різною масовою часткою, нову концентрацію можна знайти за формулою m1ω1 + m2ω2 = (m1 + m2)ω3 ; де m1, m2 – маси розчинів; ω1, ω2 – масові концентрації. При розбавленні першого розчину водою концентрація води ω2 дорівнює нулю, і формула має вигляд:
m1ω1 + mH2O 0 = (m1 + mH2O) ω3 = m1ω1 = (m1 + m2) ω3.
Приклад 3. Змішали 200 г розчину сульфатної кислоти з масовою часткою ω1 (H2SO4) = 10% і 300 г розчину з масовою часткою ω2 (H2SO4) = 40%. Якою стала масова частка кислоти в розчині?
Розв’язання. За формулою змішування m1 ω1 + m2 ω2 = (m1 +m2)ω3 ,- знаходимо концентрацію сульфатної кислоти після змішування
200г10% + 300г40% = (200г + 300г) ω3 ; 2000 + 12000 = 500ω3 ;
14000 = 500 ω3 ; ω3 = 14000 / 500 = 28%.
Масова частка кислоти в одержаному розчині дорівнює 28%.
Приклад 4. Яку масу води необхідно додати до 20 кг розчину сульфатної кислоти з масовою часткою H2SO4 40%, щоб одержати розчин з масовою часткою 25%?
Розв’язання. За формулою змішування розчину з водою:
m1 ω1 = (m1 + mH2O)ω3, - знаходимо: 20 кг 40% = (20 кг + х) 25% ; 800 = 500 + 25 х; 25х = 300 ; х = 12 кг.
До розчину необхідно додати 12 кг (або літрів) води.
Приклад 5. До розчину об’ємом 1 л з масовою часткою HNO3 60% і густиною 1,31 г/мл долили 700 мл води. Яка масова частка кислоти в одержаному розчині?
Розв’язання. В цьому прикладі дана не маса (m), а об’єм розчину (V), тому для розв’язання необхідно перевести об’єм в масу за формулою mрозчину = Vρ = 1000 мл 1,31 г/мл = 1310 г розчину кислоти.
За формулою змішування знаходимо масову частку кислоти в розчині після змішування m1ω1 = (m1 + mH2O) ω3 ;
1310г 60% = (1310г + 700г)ω3 ;
ω3 = 78600г / 2010г = 39,1% HNO3
Молярна концентрація СМ - це відношення кількості розчиненої речовини ν до об’єму розчину V або число моль розчиненої речовини в 1 літрі (1000 мл) розчину:
СМ = ν / V (моль/л) ; ν = m / M ;
СМ = m 1000 мл / М V мл ,
де m - маса розчиненої речовини, г;
М - молярна маса розчиненої речовини, г/моль.
Молярність вимірюється в моль/л і позначається літерою М. Наприклад, 1,0 М (КСІ) – одномолярний розчин хлориду калію. В одному літрі такого розчину міститься 1,0 моль або 74,5 г КСІ (М(КСІ) = 39 + 35,5 = 74,5 г/моль)
Приклад 6. Яка кількість моль сульфатної кислоти міститься в 4 літрах 0,25 М розчину?
Розв’язання. За формулою: СМ = ν / V, - знаходимо кількість моль ν :
ν = СМ V = 0,25 моль/л 4 л = 1,0 моль (H2SO4)
Приклад 7. У воді розчинили 8 г гідроксиду натрію. Об’єм розчину довели до 500 мл. Знайти молярну концентрацію NaOH в розчині. М(NaOH) = 23+16+1 = 40 г/моль.
Розв’язання. За формулою: СМ = m 1000 / M V, - знаходимо молярну концентрацію: СМ = 8 г 1000 мл / 40 г/моль 500 мл =
= 0,4 моль/л ( або = 0,4 М).
Якщо необхідно перейти від молярної концентрації до масової або навпаки, можна застосувати таку формулу:
СМ = ωρ10 / М ,
де ω - масова частка розчиненої речовини, %;
ρ - густина розчину з масовою концентрацією ω;
М – молярна маса розчиненої речовини.
Приклад 9. Яка молярна концентрація 14,6 %-го розчину фосфатної кислоти з густиною 1,08 г/мл? М(H3PO4) = 98 г/моль.
Розв’язання. Для обчислення молярної концентрації використаємо формулу СМ = ωρ10 / М; СМ = 14,6 1,08 10 / 98 = 1,6 моль/л (1,6М).
| | Приклад 10.При відновленні воднем суміші заліза(II) оксиду і міді (II) оксиду масою 15,2 г одержали 12,0 г суміші металів. Обчисліть масову частку міді оксиду у вихідній суміші. Розв'язання: Відновлення залізо(II) оксиду і мідь (II) оксиду воднем виражається рівняннями реакцій З рівнянь видно, що з одного моля будь-якого оксиду виходить при повному відновленні по 1 молю металу. Позначимо через х – число молів вихідного залізо (II) оксиду і у – вихідне число молів мідь (II)оксиду. Молярні маси оксидів дорівнюють 72 г/моль і 80 г/моль відповідно. Молярні маси заліза і міді 56 і 64 г/моль. У відповідності зі стехіометрією процесу відновлення оксидів можна скласти рівняння матеріального балансу щодо вихідних мас оксидів і мас отриманих металів 72·х + 80·у = 15,2 56·х + 64·у = 12 Таким чином, маємо 2 рівняння з двома невідомими – х та у. Розв'язок рівняння дає х = 0,1 моль; у = 0,1 моль. Маса залізо (II)оксиду дорівнює Маса мідь (II) оксиду дорівнює Масова частка мідь(II) оксиду дорівнює |
| | Приклад11. Обчисліть маси солей, що утворяться при взаємодії: а) 1,58 г аміаку і 1,58 г сірководню; б) 2,24 л аміаку і 2,24 л сірководню (за н.у.) Розв'язання: У залежності від співвідношення кількості реагуючих речовин – аміаку і сірководню продуктами реакції можуть бути або середня сіль - амонію сульфід де 17 г/моль – молярна маса аміаку. Кількість речовини сірководню дорівнює: Таким чином, вихідні речовини знаходяться в співвідношенні Речовини взято в строго стехіометричному співвідношенні, таким чином, взаємодія аміаку і сірководню відбувається відповідно до рівняння реакції Молярна маса б) як і в першому випадку, взаємодія може привести до утворення різних солей – кислої 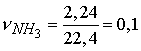 моль, моль, 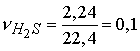 моль. моль. Таким чином, співвідношення числа молів вихідних газів отже, за таких умов йтиме реакція Молярна маса гідросульфіду амонію, |
| | Приклад 12. Суміш залізо (III) хлориду і алюміній хлориду масою 1,564 г розчинили у воді і додали розчин калій гідроксиду в надлишку. Осад, що утворився, профільтрували і прожарили. Маса осаду після прожарювання дорівнює 0,480 г. Обчисліть масові частки солей у вихідній суміші. Розв'язання: Обидві солі добре розчинні у воді і взаємодіють з лугом з утворенням відповідних малорозчинних гідроксидів металів. Запишемо рівняння реакцій в молекулярній формі: На відміну від залізо(III) гідроксиду, алюміній гідроксид виявляє амфотерні властивості і може взаємодіяти з надлишком лугу Таким чином, після обробки надлишком лугу в осаді залишиться тільки залізо(III) гідроксид За рівнянням реакції можна розрахувати кількість речовини Оскільки ця кількість Молярна маса Масова частка залізо(III) хлориду, а алюміній хлориду, |
Проведення реакцій неорганічного синтезу в конденсованих фазах накладає певні обмеження та вносе додатки , перелік яких необхідний при проведенні реакцій в рідинній фазі.
В першу чергу на реакції в рідинній фазі має вплив наявність розчинника. Природа розчинника може впливати як на швидкість , так і на механізм реакції. Іноді розчинник змінює швидкість процесу без зміни його механізма. Зустрічаються випадки , коли розчинник впливає на механізм ,а швидкість залишається незмінною. Зміну швидкості реакції без зміни механізму процесу можна очікувати внаслідок послабшення або збільшення взаємодії між реагуючими частками. Таке явище ілюструється впливом діелектричної проникності середовища на електростатичні сили, які дїють між частинами. Від в’язкості розчинника залежить швидкість дифузії та частота зіткнень реагуючих часток. Що може визначати зміну швидкості реакції, яка лімітується дифузією. В деяких випадках на швидкість може впливати сольватація або вибіркова сольватація.
Завдання для самостійної роботи : робота над рефератом по одній з вказаних тем.
Теми рефератів для студентів I курсу ХФ з дисципліни
СИНТЕЗ ХІМІЧНИХ РЕЧОВИН
Засоби виділення та очищення продуктів синтезу. Фільтрування.
Засоби виділення та очищення продуктів синтезу. Кристалізація та перекристалізація.
Хімічні реактиви,їх зберігання та робота з ними.
Способи очищення рідин.
Способи розділення сумішей.
Синтез сполук бора.
Синтез сполук міді.
Синтез сполук р-елементів VI групи
Синтез комплексних сполук кобальта.
Хімічний посуд. Використання хімічного посуду.
Шкідливі речовини в промисловості та правила роботи з ними.
Цікаві досліди в хімії.