
Ім'я файлу: Протокол Кубей Олег ХД-91 Лаб.роб. №5.docx
Розширення: docx
Розмір: 922кб.
Дата: 17.11.2020
скачати
Розширення: docx
Розмір: 922кб.
Дата: 17.11.2020
скачати
Кубей Олег ХД-91
Лабораторна робота 5
Тема: Хімічні властивості спиртів та фенолів
Мета роботи: Вивчити хімічні властивості спиртів ( одноатомних,
двохатомних та трьохатомних) та фенолів, провести хімічні досліди, вивчити якісні реакції.
Експериментальна частина
Дослід 1. Виявлення води у спирті
У пробірку наливають 1 мл етилового спирту і додають декілька кристаликів безводного сульфату міді. Які відбуваються зміни?
Спостереження: після додавання безводного сульфату міді(безбарвного) до пробірки з етиловим спиртом бачимо як змінюється забарвлення суміші на голубий колір, утворюється кристалогідрат. Це свідчить про наявність в етиловому спирті води.
CuSO4 + 5H2O = CuSO4∙5H2O
Дослід 2. Відношення спиртів до індикаторів
У дві пробірки поміщають по 3 краплі води і додають в одну пробірку кілька краплин етилового спирту в іншу - ізоамілового. Перевіряють середовище за допомогою індикатора (універсальний індикатор, фенолфталеїн).
Спостереження: після перевірки індикаторів на кислотні властивості спиртів вони не можуть зафіксувати кислотні властивості.
Дослід 3. Утворення етилату натрію та його гідроліз
У пробірку наливають 2 мл етанолу, додають шматочок очищеного металічного натрію і закривають пробкою із газовідвідною трубкою. Після повного розчинення металічного натрію утворений алкоголят розкладають водою. Додають у розчин фенолфталеїн і спостерігають за зміною кольору.
Спостереження: після додавання до етанолу металічного натрію спостерігаємо як метал розчиняється і виділяється газ без кольору і запаху. Під’єднавши пробірку до газовідводної трубки, підносимо її кінець до відкритого полум’я і бачимо як виділений газ горить.До пробірки додамо фенолфталеїн і через гідроліз алкоголяту натрію і розчин набуває малинового кольору, що свіжчить про лужне середовище.
Рівняння реакцій:
2C2H5OH + 2Na = 2C2H5ONa + H2↑
2H2 + O2 = 2H2O
Дослід 4. Окиснення етанолу перманганатом калію
Наливають в пробірку 1 мл етанолу, додають 1 мл розчину перманганату калію і нагрівають. Альдегід, що утворюється, розпізнають за характерним запахом.
Спостереження: після нагрівання суміші з фіолетового р-ну перманганату калію і етанолу бачимо як розчин змінює своє забарвлення на бурий колір і стає відчутний запах формальдегіду.
Рівняння реакції:
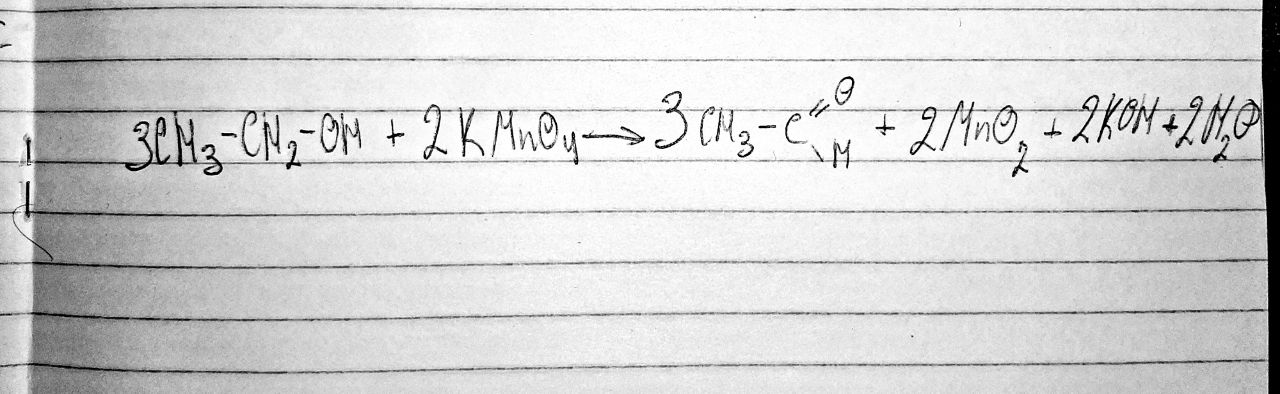
Дослід 5. Утворення гліколяту та гліцерату міді
У три окремі пробірки наливають по 2 мл 10 %-го розчину лугу і додають кілька крапель розчину сульфату міді. Утворюється осад гідроксиду міді (II). До отриманого осаду додають в першу пробірку кілька крапель етилового спирту, в другу – етиленгліколю і в третю – гліцерину. Реакційну суміш в пробірках енергійно струшують.
Спостереження: після додавання до безбарного розчину лугу голубого розчину сульфату міді бачимо як в трьох пробірках випадає осад синього кольору. Після додавання спиртів до пробірок із суспензією та енергійного струшування бачимо що в пробірці з етанолом нічого не відбувається, з етиленгліколем осад розчиняється і розчин набуває зеленуватого відтінку, з гліцерином осад розчиняється і розчин набуває темно-синього забарвення.
Рівняння реакції:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4


Дослід 6. Утворення ізопентилацетату (ізоамілацетату)
Змішують у пробірці 2 мл концентрованої оцтової кислоти, 2 мл ізоамілового спирту та 0,5 мл концентрованої сірчаної кислоти, кидають шматочки невипаленої порцеляни (центри кипіння). Суміш перемішують та обережно нагрівають, весь час струшуючи. Продукт реакції виливають у пробірку з холодною водою. Ізоамілацетат спливає на поверхню води, пахне грушевою есенцією.
Спостереження: після змішування розчинів ізоамілового спирту, оцтової кислоти та конц. H2SO4 нагріваємо нашу суміш. Далі спостерігаємо що реакційна суміш набуває темно-бурого кольору. Додаючи холодної води, бачимо як буре забарвлення стає світліим, а ізоамілацетат спливає на поверхню води та стає відчутним запах грушевої есенцієї.
Рівняння реакції:
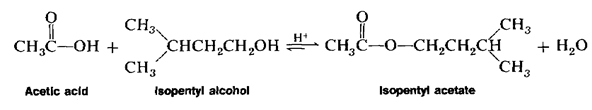
Дослід 7. Розчинність фенолу у воді
У пробірку поміщають 0,5 г кристалічного фенолу і додають 2 мл води. При струшуванні фенол частково розчиняється. Після відстоювання утворюється два шари рідини. Нижній шар – розчин води у фенолі, верхній – розчин фенолу у воді. Обережно нагріваючи розчин, спостерігаємо, що фенол повністю розчиняється у воді. При охолодженні – рідина знову розшаровується.
Спостереження: Після додавання до кристалічного фенолу з води ми спостерігаємо часткове розчинення, утворюється емульсія червонуватого кольору(фенол сам безбарвний, але через те, що він окислюється, і набуває червого відтінку). Потім суміш піддаємо нагріванню і фенол повністю розчиняється у воді. При охолодженні пробірки бачимо як рідина знову розшаровуються, нижній шар – розчин води у фенолі, верхній – розчин фенолу у воді. Подіявши розчином фенолу на універсальний індикатор, бачивши що він вказує на слабокислотні властивості фенолу.
Дослід 8. Доведення кислотного характеру фенолу (одержання феноляту натрію)
Струшують вміст пробірки з попереднього досліду до утворення емульсії та додають краплями 10%-ий розчин гідроксиду натрію. Що при цьому спостерігається? Коли до розчину утвореного у пробірці феноляту натрію додати мінеральну кислоту (НС1), то відбудеться виділення вільного фенолу.
Спостереження: Змішуючи розчини червонуватого фенолу та безбарвного гідроксиду натрію, бачимо як розчиняється фенол і утворення прозорого розчину феноляту натрію. Далі при додаванні сірчаної кислоти до утвореного розчину бачимо помутніння рідини, утворення емільсії.
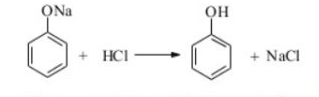
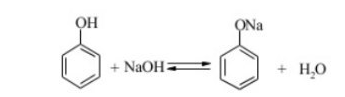 Рівняння реакції:
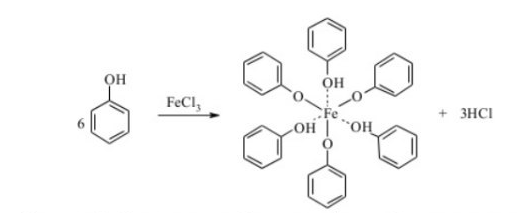
Рівняння реакції:Дослід 9. Взаємодія фенолу з хлоридом заліза (ІІІ)
У пробірку наливають 2 мл розчину фенолу і додають 2-3 краплі 2%-го розчину хлориду заліза (ІІІ). Якісна реакція на фенол.
Спостереження: При змішуванні фенолу та жовтого розчину хлориду феруму (ІІІ), спостерігаємо зміну кольору на темно-фіолковий, внаслідок утворення комплексних фенолятів феруму (ІІІ)
Рівняння реакції:
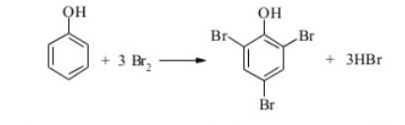
Дослід 10. Взаємодія фенолу з бромом
У пробірку наливають 0,5 мл розчину фенолу і, безперервно струшуючи пробірку, додають бромну воду. Якісна реакція на фенол.
Спостереження: додаючи до розчину фенолу жовту бромну воду, спостерігаємо як різке знебарвлення суміші.
Рівняння реакції:
Висновок: вивчили хімічні властивості спиртів ( одноатомних, двохатомних та трьохатомних) та фенолів, провели хімічні досліди та вивчити якісні реакції на них.