

4 ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
4.1 Мета експерименту
Робота була розпочата з вивчення взаємодії карбонатовмісного відходу з водними розчинами важких металів і з'ясування впливу на осадження металів з розчинів наступних факторів:
природи металу, що осаджується;
вихідної концентрації його розчину;
співвідношення мас металу в цьому розчині та доданого до нього карбонатовмісного відходу;
температури розчину;
розміру часток реагенту;
присутності інших іонів.
4.2 Методика експерименту та опис експериментальної установки
Очистка модельних розчинів стічних вод від іонів важких металів проводилися в статичних умовах наступним чином: в колби, що містять по 100 мл розчину (з концентрацією металу СМ, мг/л), додавався карбонатовмісний відхід в кількості m (в г) з розміром часток 0,25-5-0,5 мм. Отримана система витримувалася в ізотермічних умовах при перемішуванні певний час, потім розчин відокремлювався від осаду. До і після контакту з реагентом визначався вміст іонів металу в розчині. Одночасно потенціометрично контролювалося значення pH вихідних і очищених розчинів.
В роботі для вираження ефективності очищення розчинів від іонів металу з застосуванням карбонатовмісного відходу хімічної водопідготовки використовувався ступінь виділення іонів металу з розчину (СВМ,%):
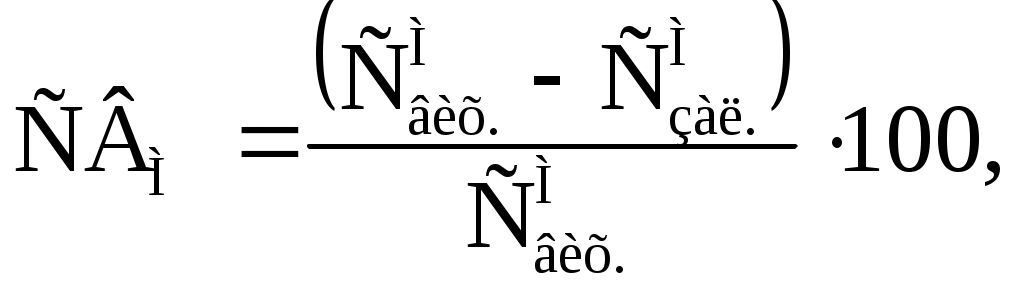 (14)
(14)

4 ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
4.1 Мета експерименту
Робота була розпочата з вивчення взаємодії карбонатовмісного відходу з водними розчинами важких металів і з'ясування впливу на осадження металів з розчинів наступних факторів:
природи металу, що осаджується;
вихідної концентрації його розчину;
співвідношення мас металу в цьому розчині та доданого до нього карбонатовмісного відходу;
температури розчину;
розміру часток реагенту;
присутності інших іонів.
4.2 Методика експерименту та опис експериментальної установки
Очистка модельних розчинів стічних вод від іонів важких металів проводилися в статичних умовах наступним чином: в колби, що містять по 100 мл розчину (з концентрацією металу СМ, мг/л), додавався карбонатовмісний відхід в кількості m (в г) з розміром часток 0,25-5-0,5 мм. Отримана система витримувалася в ізотермічних умовах при перемішуванні певний час, потім розчин відокремлювався від осаду. До і після контакту з реагентом визначався вміст іонів металу в розчині. Одночасно потенціометрично контролювалося значення pH вихідних і очищених розчинів.
В роботі для вираження ефективності очищення розчинів від іонів металу з застосуванням карбонатовмісного відходу хімічної водопідготовки використовувався ступінь виділення іонів металу з розчину (СВМ,%):
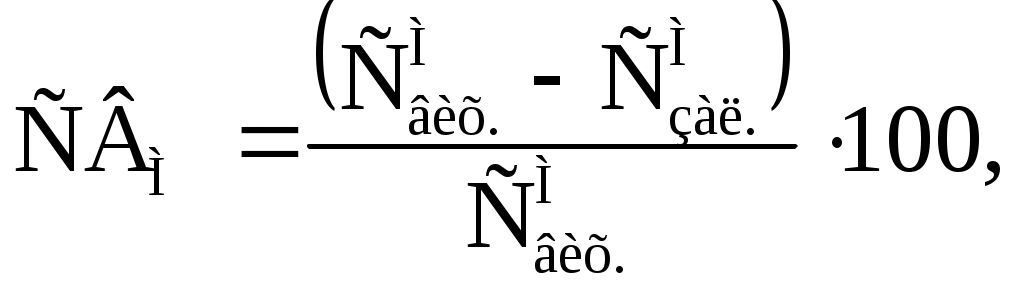 (14)
(14)| де | | – | концентрація іонів металу в вихідному розчині; |
| | | – | залишкова концентрація іонів металу в розчині після очищення. |
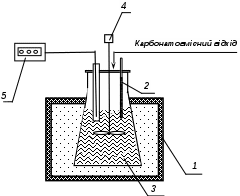
1– термостат; 2 – термометр; 3 – колба з досліджуваним розчином;
4 – механічна мішалка; 5 – рН-метр
Рисунок 4.1 – Схема експериментальної установки
Розглядаючи карбонатовмісний відхід як специфічний реагент, характеризували його активність в процесах виділення іонів металів з розчинів кількістю металу в мг, що виділився при впливі на розчин 1 г реагенту при даній температурі води та початковій концентрації розчиненої речовини (А, мг/г):
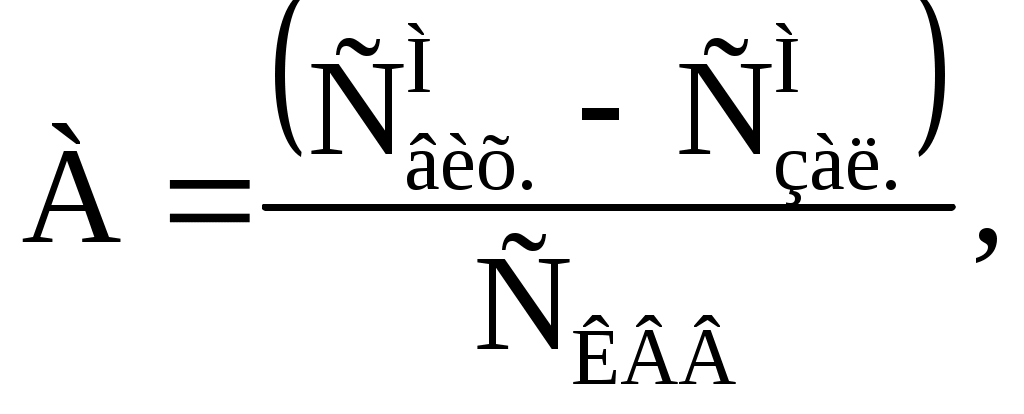 (15)
(15)| де | | – | вміст карбонатовмісного відходу, г/л. |
Співвідношення мас металу в досліджуваному розчині та доданого до нього карбонатовмісного відходу позначалося як N, мг/г.
4.3 Методика аналізів
4.3.1 Комплексонометричний метод визначення міді
Сутність методу: Метод заснований на тому, що органічні сполуки визначеного типу, що називаються комплексонами, досить швидко реагують з іонами металів з утворенням стійких хелатних комплексів. В якості індикатора для визначення міді використовувався мурексид – амонієва сіль пурпурової кислоти, в якості комплексону використовували трилон Б.
Хід аналізу: Для аналізу відбирали аліквоти досліджуваного розчину, переносили в колби для титрування, додавали 10 мл 0,1 Н розчину аміаку та 10 мл 0,1 Н розчину хлориду амонію для створення буфера, доливали воду до 100 мл. Для усунення заважаючого впливу іонів кальцію перед титруванням міді маскували, додаючи фторид натрію. Далі додавали індикатор – мурексид та титрували 0,05 Н розчином трилону Б до переходу жовтого забарвлення в фіолетове.
Концентрація міді (в г/л) в досліджуваному розчині розраховувалася за формулою:
| де | 0,05 | – | нормальна концентрація трилону Б, г-екв/л; |
| | Vтрилон Б | – | об’єм трилону Б, що витрачається на титрування, мл; |
| | 63,546 | – | еквівалентна маса міді, г-екв; |
| | V | – | об’єм аналізованої проби, мл [66]. |
4.3.2 Фотометричне визначення невеликої кількості хрому
Діапазон визначуваних концентрацій: 0,01 - 1,0 мг/л.
Сутність методу: Дифенілкарбазид реагує в кислому середовищі з Cr2О72– з утворенням сполуки фіолетового кольору. Метод дуже чутливий при X = 540 нм.
Хід аналізу: Відбирали такий об’єм розчину, щоб в ньому містилося 1-50 мкг загального хрому, розбавляли водою до 50 мл, нейтралізували, додавали 2-3 краплі 2 Н розчину сульфатної кислоти, 10 мл розчину амоній персульфату та кип'ятили 20-25 хв.; весь хром при цьому окислюється, а надлишок персульфату розкладається. Це важливо, оскільки навіть малі кількості персульфату заважають визначенню. Після охолодження переносили розчин в мірну колбу на 100 мл, додавали 1 мл розчину сульфатної кислоти (1 : 1), 0,3 мл 85%-вої ортофосфатної кислоти, розбавляли водою до мітки, перемішували та доливали 2 мл розчину дифенілкарбазиду. Через 10-15 хв. визначали оптичну густину розчину при довжині хвилі 540 нм, розчин порівняння – вода.
Час аналізу: 50 хв.
Стандартне відхилення: ± 4%.
Розрахунок: Використовували метод градуювального графіка та знаходили за графіком С, мг/л. Тоді вміст хрому визначався за формулою:
| де | V | – | об’єм проби, взятої для аналізу мл [66]. |
4.3.3 Фотометричний метод визначення загального заліза
Діапазон визначуваних концентрацій: 0,02 - 4,0 мг/л.
Сутність методу: Метод заснований на попередньому руйнуванні комплексів заліза та відновленні всіх форм заліза до Fe2+, який утворює з орто-фенантроліном червоно-фіолетовий комплекс з максимумом світлопоглинання при довжині хвилі 510 нм.
Хід аналізу: Відбирали такий об’єм розчину, щоб в ньому містилося не більше 0,15 мг заліза, кип'ятили 10-15 хв. для переведення всіх сполук в іонний стан. При необхідності розчин фільтрували. Після охолодження переносили розчин в мірну колбу на 50 мл і розбавляли водою до мітки. Потім пробу переносили в конічну колбу, додавали 1 мл розчину гідроксиламіну, 1 мл розчину орто-фенантроліну і по краплях концентрованого аміаку до рН = 3. Вимірювання оптичної густини розчину виконували на КФК-2 при довжині хвилі 540 нм, розчин порівняння – вода.
Час аналізу: 30 хв.
Стандартне відхилення: ± 2%.
Розрахунок: Використовували метод градуювального графіка та знаходили за графіком С, мг/л. Тоді вміст заліза визначався за формулою:
| де | V | – | об’єм проби, взятої для аналізу мл [67]. |
4.3.4 Метод визначення міді з використанням діетилдитіокарбамату
Мінімальна визначувана концентрація: 2 мкг/л.
Сутність методу: Кількісне визначення міді засноване на утворенні забарвленого в жовтий колір діетилдитіокарбамату міді при взаємодії з діетилдитіокарбаматом свинцю в хлороформі з іонами міді (II).
Хід аналізу: 50 мл аналізованої проби поміщали в ділильну воронку, доливали 2 мл 10%-вого розчину калію-натрію виннокислого, 5 мл ацетатного буфера та екстрагували 10 мл розчину діетилдитіокарбаматом свинцю в хлороформі протягом 3 хвилин. Після розділення шарів хлороформний екстракт діетилдитіокарбамату міді переносили в кювету з товщиною шару 2 см. Оптичну густину хлороформного екстракту діетилдитіокарбамату міді вимірювали проти хлороформу на КФК-3 при довжині хвилі 436 нм. Вимірювання оптичної густини необхідно проводити швидко, щоб уникнути випаровування хлороформу.
Розрахунок: Вміст міді в пробі знаходили за калібрувальною кривою. Рівняння калібрувальної кривої розраховане за методом найменших квадратів.
Концентрацію міді (мкг/л) визначали за формулою:
СCu = Сх р, (19)
| де | Сх | – | вміст міді в пробі, знайдений за калібрувальним графіком, мкг/л; |
| | р | – | ступінь розбавлення вихідної проби розчину. |
Для побудови калібрувальної кривої в ділильних воронках до 50 мл дистильованої води доливали відповідно 1,0; 3,0; 5,0; 8,0 і 10,0 мл розчину з концентрацією 1 мкг Сu/ мл і виконували визначення, як описано вище.
Час аналізу: Визначення одиничної проби – 2 години. Серія з 6 проб визначається за 7 годин.
Стандартне відхилення: ± 10% [67].
4.3.5 Метод визначення цинку з використання дитизону
Мінімальна визначувана концентрація: 2 мкг/л.
Сутність методу: Кількісне визначення цинку засноване на взаємодії з дифеніл-тіокарбазоном (дитизоном) в чотирихлористому вуглецю, в результаті чого утворюється дитизонати цинку – забарвлений в червоний колір комплекс з максимумом світлопоглинання при довжині хвилі 535 нм.
Хід аналізу: До розчину цинку додавали 4 мл 25%-вого розчину тіосульфату натрію, 5 мл ацетатного буферного розчину, 10 мл 0,004%-вого розчину дитизону в чотирихлористому вуглецю. Розчин дитизонату цинку переносили в кювету з товщиною шару 1 см і вимірювали оптичну густину розчину на КФК-3 при довжині хвилі 535 нм проти чотирихлористого вуглецю.
Розрахунок: Вміст цинку в пробі знаходили за калібрувальною кривою. Рівняння калібрувальної кривої розраховане за методом найменших квадратів
Концентрацію цинку (мкг/л) визначали за формулою :
СZn = Сх р, (20)
| де | Сх | – | вміст цинку в пробі, знайдений за калібрувальним графіком, мкг/л; |
| | р | – | ступінь розбавлення вихідної проби розчину. |
Побудова калібрувальної кривої: В девять ділильних воронок помістили по 50 мл дистильованої води, додали по 0; 2,5; 5; 7,5; 10 мл розчину сульфату цинку концентрацією 5 мкг Zn/мл і по 3; 6; 10 мл розчину ZnCl концентрацією 1,119 мкг Zn/мл. Провели визначення, як описано вище, побудували калібровану криву.
Час аналізу: Визначення одиничної проби – 2 години. Серія з 6 проб визначається за 7 годин.
Стандартне відхилення: ± 10% [66].
4.3.6 Фотометричне визначення нікелю з диметилгліоксимом
Діапазон визначених концентрацій: 0,2-5,0 мг/л.
Сутність методу: Іони нікелю в слабкоаміачному середовищі в присутності сильного окислювача вступають в реакцію з диметилгліоксиом з утворенням комплексної сполуки червоного кольору.
Хід аналізу: В мірну колбу ємністю 100 мл поміщали 50 мл проби, додавали 10 мл насиченого розчину брому та суміш перемішали. Після цього додавали 12 мл розчину аміаку, 4 мл розчину діметилгліоксиму і доливали дистильованою водою до мітки. Одночасно проводили холостий дослід з 30 мл дистильованої води. З величини оптичної густини проби вичитали величину оптичної густини холостої проби і за градуювальним графіком знаходили вміст нікелю.
Час аналізу: 30 хв.
Стандартне відхилення: ± 2%.
Розрахунок: Використовували метод градуювального графіка та знаходили за графіком Сх, мг/л. Тоді вміст нікелю визначався за формулою:
| де | V | – | об’єм проби, взятої для аналізу мл [67]. |
4.4 Результати експерименту та їх обговорення
4.4.1 Осадження з розчину міді (ІІ)
Дослідження осадження міді (II) з розчинів з використанням карбонатовмісного відходу проводилися на модельних розчинах різної концентрації, приготованих розчиненням кристалогідрату CuSО4 6Н2О. Концентрацію міді визначали комплексонометричним методом (для високих концентрацій) і спектрофотометричним методом з діетилдитіокарбаматом (для малих концентрацій). рН розчинів контролювали потенціометрично на іономірі И-120М з точністю до pH ± 0,05.
Для отримання вихідної інформації про процеси виділення з розчинів міді за допомогою карбонатовмісного відходу досліджувався розчин, що містить 500 мг/л міді (II), до якого додавався карбонатовмісний відхід з розрахунку 40 г/л (значення N для цієї системи складає величину 12,5 мг/г). Отримані результати наведені в табл. 4.1 і в графічному вигляді представлені на рис. 4.2
Таблиця 4.1 – Активність карбонатовмісного відходу в процесах виділення міді (ІІ) з розчинів. Добавка карбонатовмісного відходу – 40 г/л
| № | Час, хв. | рН | Залишкова концентрація Сu2+ в розчині (ССuзал), мг/л | Ступінь виділення міді (СВСu), % | Активність карбонатовмісного відходу (А), мг/л |
| | 0 | 5,10 | 500,00 | – | – |
| 1 | 5 | 6,63 | 38,51 | 92,3 | 11,5 |
| 2 | 10 | 6,90 | 28,32 | 94,3 | 11,8 |
| 3 | 15 | 7,07 | 13,50 | 97,3 | 12,2 |
| 4 | 30 | 7,08 | 8,14 | 98,4 | 12,3 |
| 5 | 60 | 7,23 | 4,61 | 99,1 | 12,4 |
| 6 | 120 | 7,31 | 1,88 | 99,6 | 12,5 |
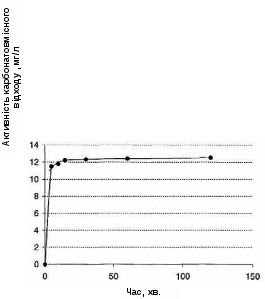
Рисунок 4.2 – Залежність активності карбонатовмісного відходу (А) в процесах виділення міді (ІІ) з розчинів концентрацією 500 мг/л від часу.
СКВВ = 40 г/л
Судячи з отриманих даних, процес виділення міді під дією карбонатовмісного відходу протікає досить швидко та ефективно. Вже через 5 хв. досягається ступінь виділення міді, що перевищує 90%, а через 2 години ступінь виділення стає майже 100%. Специфічною особливістю є також те, що швидкий початковий етап виділення міді поступово переходить в уповільнену стадію. Такий характер зміни активності та ступеня виділення в часі типовий для процесів, в яких відбувається зменшення концентрації реагентів в часі. В конкретному випадку це пов'язано з прогресуючим зменшенням концентрації міді в розчині в міру її осадження з розчину.
Виникає питання: чи можливий такий ефективний процес для більш розбавлених вихідних розчинів з меншою питомою витратою карбонатовмісного відходу, тобто зі збільшенням значення N ?
Для отримання відповіді на це питання було вивчено виділення міді під впливом карбонатовмісного відходу з розчинів з меншою в 10 разів вихідною концентрацією (50 мг/л). До цього розчину додавалося така кількість карбонатовмісного відходу (1 г/л), яке забезпечувало в системі значення N = 50 мг/г. Результати дослідження наведені в табл. 4.2, а графік зміни активності показаний на рис. 4.3.
Таблиця 4.2 – Активність карбонатовмісного відходу в процесах виділення міді (ІІ) з розчинів. Добавка карбонатовмісного відходу – 40 г/л
| № | Час, година | рН | Залишкова концентрація Сu2+ в розчині (ССuзал), мг/л | Ступінь виділення міді (СВСu), % | Активність карбонатовмісного відходу (А), мг/л |
| | 0 | 5,30 | 50,00 | – | – |
| 1 | 1 | 6,18 | 18,82 | 62,4 | 31,2 |
| 2 | 6 | 6,49 | 7,31 | 85,4 | 42,7 |
| 3 | 12 | 6,87 | 2,94 | 94,1 | 47,1 |
| 4 | 24 | 7,36 | 1,58 | 96,8 | 48,4 |
| 5 | 48 | 7,78 | 0,82 | 98,4 | 49,2 |
| 6 | 72 | 7,96 | 0,31 | 99,4 | 49,7 |
З зіставлення табл. 4.1, 4.2 і рис. 4.2, 4.3 видно, що таке значне зменшення концентрації вихідного розчину та підвищення значення N не привело до зміни характеру та позитивних кінцевих результатів процесу. Як і в попередньому випадку, мідь з розчину осідає досить швидко, і процес завершується практично повним її виділенням з розчину. Також як і в попередньому випадку, швидка початкова стадія процесу поступово переходить в стадію сповільнену. Разом з тим є і суттєві відмінності в досліджених процесах. Так, процес виділення міді з розчину з концентрацією 50 мг/л протікає значно повільніше. Це відноситься як до початкового етапу, так і подальшої сповільненої стадії. Дійсно, якщо в разі першого розчину (ССu = 500 мг/л) вже через 5 хвилин досягається ступінь виділення, що дорівнює 92,3%, то в разі другого розчину (ССu = 50 мг/л) навіть через годину ступінь виділення становить тільки 62,4%. Аналогічно, якщо в разі першого розчину вже через 2 години досягається ступінь виділення, що складає, 99,6%, то для іншого розчину навіть після 72 годин СВСu = 99,4%.
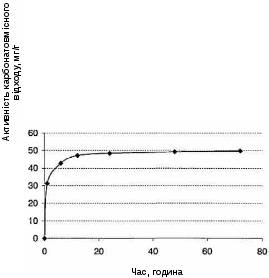
Рисунок 4.3 – Залежність активності карбонатовмісного відходу (А) в процесах виділення міді (ІІ) з розчинів концентрацією 50 мг/л від часу.
СКВВ = 1 г/л
Цікаво також відзначити, що в разі першого розчину навіть після досягнення концентрації розчину 50 мг/л (що має місце приблизно на четвертій хвилині), процес продовжує протікати досить інтенсивно. Так, зменшення концентрації в цьому розчині з 50 мг/л до 8 мг/л (ССu = 85%) досягається приблизно за 27 хв., в той час як у випадку другого розчину (ССu = 50 мг/л) таки ступінь виділення міді досягається тільки через 6 годин і т.д. Звідси очевидна зворотна залежність швидкості процесу виділення міді від значення N – співвідношення маси міді та карбонатовмісного відходу в системі, що цілком зрозуміло, оскільки більш високому значенню N відповідає велике «навантаження», що припадає на одиницю маси та поверхні карбонатовмісного відходу.
З метою з'ясування чи збережеться ця залежність для більш концентрованих розчинів були проведені дослідження трьох розчинів з вихідними концентраціями 2, 10 і 20 г/л, до яких додавалася одна і та ж кількість карбонатовмісного відходу (50 г/л), що відповідало значенням N для цих систем відповідно 40, 200 і 400 мг/г. Результати наведені в табл. 4.3 і в вигляді графіків залежності активності від часу показані на рис. 4.4.
Таблиця 4.3 – Активність карбонатовмісного відходу в процесах виділення міді (ІІ) з розчинів. Добавка карбонатовмісного відходу – 50 г/л
| № | Час, година | рН | Залишкова концентрація Сu2+ в розчині (ССuзал), мг/л | Ступінь виділення міді (СВСu), % | Активність карбонатовмісного відходу (А), мг/л |
| 1 | 2 | 3 | 4 | 5 | 6 |
| Система № 1: N = 40 мг/г | |||||
| | 0 | 4,64 | 2,00 | – | – |
| | 0,5 | 6,51 | 1,28 | 36,0 | 14,4 |
| | 1 | 6,78 | 1,13 | 43,5 | 17,4 |
| | 3 | 7,08 | 0,89 | 55,5 | 22,2 |
| | 12 | 7,13 | 0,78 | 61,0 | 24,4 |
| | 24 | 7,16 | 0,67 | 66,5 | 26,6 |
| | 48 | 7,34 | 0,43 | 78,5 | 31,4 |
| | 72 | 7,51 | 0,005 | 97,5 | 39,0 |
| Система № 2: N = 200 мг/г | |||||
| | 0 | 4,18 | 10,0 | – | – |
| | 0,5 | 6,24 | 8,39 | 16,1 | 32,2 |
| | 1 | 6,68 | 5,85 | 41,5 | 83,0 |
| | 3 | 6,93 | 5,51 | 44,9 | 89,8 |
| | 12 | 7,12 | 3,18 | 68,2 | 136,4 |
| | 24 | 7,21 | 1,71 | 82,9 | 165,8 |
| | 48 | 7,32 | 1,21 | 87,9 | 175,8 |
| | 72 | 7,38 | 0,61 | 93,9 | 187,8 |
Продовження табл. 4.3
| 1 | 2 | 3 | 4 | 5 | 6 |
| Система № 3: N = 400 мг/г | |||||
| | 0 | 3,37 | 20,0 | – | – |
| | 0,5 | 5,43 | 13,75 | 31,3 | 110 |
| | 1 | 6,01 | 13,39 | 33,1 | 125 |
| | 3 | 6,17 | 12,52 | 37,4 | 150 |
| | 12 | 6,75 | 5,31 | 73,5 | 294 |
| | 24 | 6,92 | 3,05 | 84,8 | 393 |
| | 48 | 7,12 | 2,72 | 86,4 | 395 |
| | 72 | 7,21 | 2,02 | 89,9 | 397 |
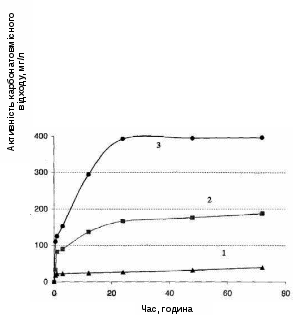
Рисунок 4.4 – Залежність активності карбонатовмісного відходу (А) в процесах виділення міді (ІІ) з розчинів із вихідною концентрацією: 1 – 2 г/л;
2 – 10 г/л; 3 – 20 г/л від часу. СКВВ = 50 г/л
Як видно з отриманих даних, основні закономірності процесу зберігаються і в цьому випадку: виділення міді з розчинів протікає досить швидко та ефективно. За час експериментів вдалося отримати високі (хоча і не 100%) ступені виділення міді з розчину. З табл. 4.3 видно, що ступінь виділення міді, що досягається за 72 години збільшується зі зменшенням значення N.
Разом з тим, отримані результати дозволяють зробити ще ряд висновків. Так, із зіставлення залежностей ступеня виділення міді від часу (табл. 4.1 – 4.3) можна зробити висновок, що протікання процесів в часі залежить не тільки від значення N, а й від вихідної концентрації розчинів. Причому цей зв'язок досить складний і неоднозначним. Ці дані є непрямим свідченням відносної складності процесів взаємодії карбонатовмісного відходу з розчинами та виділення міді з розчинів.
Другим висновком з отриманих результатів є зростання максимально досягнутого значення активності реагенту зі збільшенням N. Цей факт є свідченням того, що, незважаючи на відмінність досліджуваних систем за концентраціями вихідних розчинів і значенням N, для всіх цих систем реалізується ситуація «карбонатовмісний відхід у надлишку». У зв'язку з цим можна очікувати, що максимально досягнуте в цих дослідах значення А для карбонатовмісного відходу, що дорівнює 397 мг л, не є для нього граничним.
Виникає природне запитання: яке ж граничне значення активності карбонатовмісного відходу в процесах виділення міді з сульфатних розчинів? Для з'ясування цього питання була поставлена серія дослідів з системами, в яких послідовно в широкому інтервалі змінювалося значення N, аж до значення 5000 мг/г.
Судячи за даними, отриманими раніше, 72 години є достатнім часом для з'ясування основних закономірностей процесів виділення міді з розчинів із використанням карбонатовмісного відходу. Беручи це до уваги, експеримент виконувався наступним чином: до 100 мл розчину міді різної концентрації (ССuвих.), додавали карбонатовмісний відхід в кількості 0,1 г і витримували в ізотермічних умовах (20°С) при перемішуванні три доби. Далі проводили аналіз розчинів за описаною вище методикою. Дані експерименту представлені в табл. 4.4 і графічно показані на рис. 4.5.
Таблиця 4.4 – Активність карбонатовмісного відходу в процесах виділення міді (ІІ) з розчинів різних вихідних концентрацій.
Добавка карбонатовмісного відходу – 1 г/л
| № | Вихідна концентрація Сu2+ в розчині (ССuвих..), мг/л | рН | Залишкова концентрація Сu2+ в розчині (ССuзал), мг/л | Активність карбонатовмісного відходу (А), мг/л | Співвідношення мас металу в досліджуваному розчині та доданого до нього карбонатовмісного відходу (N), мг/г |
| | 50 | 7,96 | 0,31 | 49,7 | 50 |
| | 100 | 7,84 | 0,72 | 99,3 | 100 |
| | 200 | 7,47 | 1,84 | 198,2 | 200 |
| | 300 | 7,02 | 6,44 | 293,6 | 300 |
| | 500 | 6,88 | 28,78 | 471,2 | 500 |
| | 1000 | 6,45 | 125,4 | 874,6 | 1000 |
| | 2000 | 5,60 | 824,5 | 1175,5 | 2000 |
| | 5000 | 4,90 | 3692,9 | 1307,1 | 5000 |
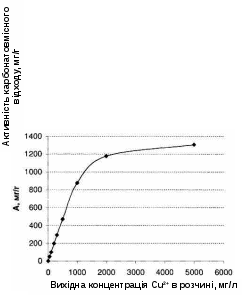
Рисунок 4.5 – Залежність активності карбонатовмісного відходу (А) від вихідної концентрації розчину (ССuвих.) для іонів міді (ІІ) в діапазоні концентрацій 50-5000 мг/л, СКВВ = 50 г/л, час контактування – 72 години
Як видно з даних табл. 4.4 і рис. 4.5, при відносно невеликих концентраціях вихідних розчинів (до 500 мг/л) ступінь виділення, що досягається за 72 години, перевищує на початку 99% (розчини з ССuвих. < 200 мг/л), а потім 95%. З ростом концентрації вихідних розчинів ступінь виділення продовжує знижуватися, але ще для розчину, що містить 1000 мг/л він досить високий (87,4%).
Ситуація істотно змінюється при переході до більш концентрованих розчинів. Досягнутий для них ступінь виділення вже принципово нижче (для розчину з 2000 мг/л він становить 58%, а для розчину з 5000 мг/л всього лише 26%) і вже навряд чи може бути пояснене тільки нестачею часу. Швидше за все, даний факт пов'язаний з досягненням гранично допустимих (рівноважних) значень активностей для карбонатовмісного відходу по міді. Таким чином, величина цієї активності становить величину 1300 мг/г.
З отриманих результатів (рис. 4.5) також випливає висновок, що аж до розчинів з концентрацією міді 1300 мг/л взаємодія карбонатовмісного відходу з розчинами міді протікає в режимі "надлишок карбонатовмісного відходу" і тільки в більш концентрованих розчинах картина змінюється на протилежну.
Отримані дані не можуть розглядатися в якості рівноважних термодинамічно обґрунтованих результатів. Не виключено, що гранична (рівноважна) активність карбонатовмісного відходу щодо міді дещо більше наведеного вище значення (1300 мг/г). Однак в практичному відношенні отримані значення активностей (табл. 4.4) необхідні. З одного боку, вони дають уявлення про максимальні "можливості" карбонатовмісного відходу як реагенту в процесах виділення міді з розчинів, а з іншого, характеризують процес протягом достатньо тривалого проміжку часу (72 години) для систем з великим інтервалом значень N і вихідних концентрацій розчинів міді. Отже, отримані значення активностей можуть бути використані в якості вихідних даних при проектуванні оптимального технологічного процесу виділення міді з розчинів з використанням карбонатовмісного відходу.
Знання ж меж переходу від ситуації "карбонатовмісний відхід у надлишку" до варіанту, коли в надлишку іони міді, дозволяє рекомендувати оптимальну технологічну стратегію виділення міді з використанням карбонатовмісного відходу. Так, наприклад, у разі необхідності роботи з висококонцентрованими розчинами міді доцільно спочатку провести осадження міді в режимі "нестача карбонатовмісного відходу". При цьому буде досягнута максимальна ефективність використання реагенту. Розбавлений розчин, що пройшов таку попередню очистку, більш доцільно доочистити, наприклад, до рівня ГДК в режимі "надлишок КСВ" і т.д.
Особливий і цілком зрозумілий інтерес представляло дослідження можливості та умов глибокого очищення розчинів від міді за допомогою карбонатовмісного відходу. Далі наведені результати дослідження можливості очистки від іонів міді (II) до рівня гранично допустимих концентрацій (ПДКСu = 0,01 мг/л) розчинів різних вихідних концентрацій і дані про вплив на ці процеси часу, температури і інших чинників.
Для загального уявлення розрахуємо теоретично, яке значення pH розчину необхідно досягти для осадження Сu(ОН)2, щоб залишкова концентрація міді не перевищувала ПДКСu = 0,01 мг/л (1,6 10–7 моль/л). Для цього скористаємося добутком розчинності гідроксиду ДРСu(ОН)2 = 8,3 10–20.
рН = 14 – рОН = 14 + lg[OH¯] = 14 + lg(KСu(ОН)2 / CСu)1/2
рН = 14 + 1/2 lg (8,3 10–20 / 1,6 10–7) = 7,86
За літературними даними для вилучення міді (Сзал < 1,6 10–7 моль/л) у вигляді важкорозчинного Сu(ОН)2 необхідно потрапити в діапазон 7,1 ≤ рН ≤ 14, початок осадження гідроксиду настає починається вже при рН = 4,2 [94].
Модельні розчини готувалися з солі СuSО4 6Н2О з урахуванням вмісту Сu2+ в стічних водах цехів різних підприємств. Очищення розчинів проводилося в статичних умовах: до 100 мл очищуваного розчину заданої концентрації (концентрація розрахована по міді, ССuвих.., мг/л) додавали наважку карбонатовмісного відходу з розміром частинок 0,25-0,50 мм, перемішували в ізотермічних умовах (20°С) протягом певного часу. Далі очищений розчин аналізували на наявність іонів міді, контролювали pH і розраховували ступінь виділення міді з розчину.
Дослідження було розпочато з вивчення залежності ступеня виділення міді від часу для розчинів з концентрацією 50, 200 і 500 мг/л, до яких додавався карбонатовмісний відхід з розрахунку N = 1,25; 5; 12,5 мг/г відповідно. Отримані дані представлені в табл. 4.5 і у вигляді графіка залежності ступеня виділення від часу представлені на рис. 4.6.
Таблиця 4.5 – Залежність ступеня виділення Сu (ІІ) від часу контактування з карбонатовмісним відходом для розчинів різних концентрацій.
Вміст КВВ = 40 г/л
| № | Час, година | рН | Залишкова концентрація Сu2+ в розчині (ССuзал), мг/л | Ступінь виділення міді (СВСu), % |
| Система № 1: N = 1,25 мг/л | ||||
| | – | 5,30 | 50,00 | – |
| 1 | 5 | 8,29 | 0,061 | 99,9 |
| 2 | 10 | 8,32 | 0,042 | 99,9 |
| 3 | 15 | 8,36 | 0,010 | 100,0 |
| Система № 2: N = 5 мг/л | ||||
| | – | 5,17 | 200,0 | – |
| 4 | 5 | 7,90 | 0,502 | 99,7 |
| 5 | 10 | 8,01 | 0,340 | 99,8 |
| 6 | 15 | 8,23 | 0,198 | 99,9 |
| 7 | 30 | 8,29 | 0,008 | 100,0 |
| Система № 3: N = 12,5 мг/л | ||||
| | – | 5,10 | 500,0 | – |
| 8 | 5 | 6,63 | 38,51 | 92,3 |
| 9 | 10 | 6,90 | 28,32 | 94,3 |
| 10 | 15 | 7,07 | 13,50 | 97,3 |
| 11 | 30 | 7,08 | 8,14 | 98,4 |
| 12 | 60 | 7,23 | 4,61 | 99,1 |
| 13 | 120 | 7,31 | 1,88 | 99,6 |
| 14 | 180 | 7,39 | 0,01 | 99,9 |
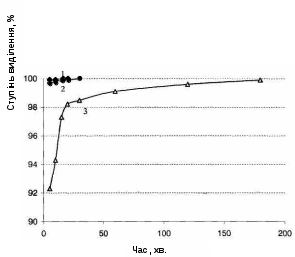
Рисунок 4.6 – Залежність ступеня виділення Сu2+ від часу для розчинів з вихідною концентрацією: 1 – 50 мг/л; 2 – 200 мг/л; 3 – 500 мг/л. СКВВ = 40 г/л
Як видно з табл. 4.5 і рис. 4.6, очистка розбавлених розчинів до рівня ГДК в цих умовах відбувається досить швидко. Так, для очищення розчинів з ССuвих. = 50 і 200 мг/л потрібно відповідно 15 і 30 хв. Для більш концентрованих розчинів необхідно кілька годин (3 години для розчину, що містить 500 мг/л міді) і т.д.
Таким чином, очищення розчинів з концентрацією міді менше 500 мг/л до рівня ГДК з використанням 40 г/л карбонатовмісного відходу цілком
Ще одним цікавим результатом виявилося те, що витрата карбонатовмісного відходу, необхідна для очищення мідьвмісних розчинів до рівня ГДК, різко зменшується в міру підвищення температури розчинів, що очищуються (табл. 4.6). При цьому істотно прискорюється осадження іонів міді (II) і досягається велика повнота очищення. Так, при нагріванні до 60°С іони міді видаляються з розчину (ССuвих. = 50 мг/л) до рівня ГДК в присутності 10 г/л карбонатовмісного відходу (N = 5 мг/г), в той час як при проведенні процесу при 20°С витрата карбонатовмісного відходу склала 20 г/л (N = 2,5 мг/г). Таким чином, при підвищенні температури розчину на 40°С необхідна кількість карбонатовмісного відходу зменшується в 2 рази. Цілком ймовірно, підвищення ефективності очищення гарячих розчинів пов'язано зі збільшенням розчинності шламу, посиленням гідролізу карбонатів кальцію і магнію, що входять до його складу і, в кінцевому рахунку, з посиленням гідролізу по катіону Сu2 +. Однак, для того, щоб оцінити, що буде економічно вигідніше: нагрівати стічних води або збільшувати витрату карбонатовмісного відходу, необхідні додаткові дослідження.
Таблиця 4.6 – Залежність ступеня виділення Сu (ІІ) від витрати карбонатовмісного відходу
| № | Р, г/л | N, мг/г | рН | Залишкова концентрація Сu2+ в розчині (ССuзал), мг/л | Ступінь виділення міді (СВСu), % |
| Температура розчину – 20°С | |||||
| 1 | 0 | | 5,30 | 50,00 | – |
| 2 | 5 | 10 | 6,93 | 2,45 | 95,1 |
| 3 | 10 | 5 | 7,93 | 0,41 | 99,2 |
| 4 | 20 | 2,5 | 8,09 | 0,07 | 99,9 |
| 5 | 40 | 1,25 | 8,29 | 0,06 | 99,9 |
| Температура розчину – 60°С | |||||
| 6 | 0 | | 5,40 | 50,00 | – |
| 7 | 5 | 10 | 8,10 | 0,106 | 99,8 |
| 8 | 10 | 5 | 8,31 | 0,099 | 99,8 |
| 9 | 20 | 2,5 | 8,45 | 0,036 | 99,9 |
| 10 | 40 | 1,25 | 8,53 | 0,016 | 100,0 |
Висновки:
1. Показана можливість використання карбонатовмісного відходу хімічної водопідготовки теплоелектростанцій для ефективного очищення кислих водних розчинів від іонів міді (II).
2. Показано, що процес виділення міді з розчинів при дії на них карбонатовмісного відходу умовно можна розбити на два етапи: швидкий початковий і уповільнений наступний.
3. Встановлено, що витрата карбонатовмісного відходу зменшується, а повнота осадження з розчинів зростає при збільшенні часу контакту та підвищенні температури очищуваного розчину.
4. Встановлено, що максимальна кількість міді, яке може бути виділено при дії на розчин 1 г карбонатовмісного відходу становить 1300 мг.
5. Показана можливість і знайдені умови очищення розчинів міді різних концентрацій до рівня ГДК з використанням карбонатовмісного відходу.
1 2 3 4 5