
2. Елементи статистичної фізики
1 Статистичний метод дослідження термодинамічних систем. Зв’язок термодинамічних параметрів з динамічними характеристиками руху молекул. Відомості з теорії ймовірностей. Статистичний розподіл молекул та його значення .
Статистичний метод дослідження термодинамічних систем заснований на конкретних уявленнях про структурні елементи, з яких система складається (молекул); з уявлень про їх природу, про характер їх рухів. Але тому що елементів дуже багато, динамічні характеристики їх руху, руху молекул, позбавлені фізичного змісту, - тобто з ними не можна оперувати, - фізичний зміст мають тільки середні значення цих характеристик. Одне з основних положень статистичної теорії, так звана ергодична аксіома , або, інколи, ергодична теорема, стверджує, що середнє історичне значення динамічної характеристики, тобто середнє за часом існування, для кожної молекули, співпадає з середнім статистичним , тобто з середнім значенням даної характеристики, розрахованому по всіх молекулах системи. Виконуються спроби довести це твердження як теорему, але поки що певні докази відсутні. Середні статистичні значення характеристик розраховуються за методами математичної статистики, тому теорія називається статистична фізика . При розгляді руху термодинамічної системи в цілому встановлюються зв’язки між середніми значеннями характеристик окремих молекул та термодинамічними параметрами стану системи в цілому, як це відтворює основне рівняння молекулярно-кінетичної теорії (5.13), наприклад.
Познайомимося з методами математичної статистики та з прийомами розрахунку середніх статистичних значень динамічних характеристик.
Статистичний метод оперує з випадковими подіями та випадковими величинами . Випадковими називаються події, які можуть відбуватися або не відбуватися за одних і тих саме умов досліду. Наприклад, при підкидання монети може випадати орел чи решітка, при роздачі гральних карт випасти та чи інша карта, гральні кості випадати тим чи іншим числом очок і таке інше. Кількісно можливість реалізації випадкової події А характеризується ймовірністю або математичним очікуванням Р(А) . Ймовірність події А визначається за частотним або часовим фактором:
де N іT – загальна кількість дослідів та загальний час дослідження, а N ( A ) та t ( A ) – відповідно кількість дослідів та тривалість часу з подією А під час дослідження. Так для орла і решітки ймовірність дорівнює 0,5, а ймовірність випадіння туза пікового у „мар’яжі” дорівнює 1/32 і так далі. Звичайно йдеться про нескінчену кількість дослідів та нескінчений час дослідження. Під час гри може п’ять разів підряд випадати орел і таке інше. Ймовірність достеменної події приймається за одиницю , а ймовірність події, що не може реалізуватись в даних умовах досліду, приймається за нуль .
Випадкові події називаються взаємо виключними , якщо реалізація однієї з них виключає можливість іншої. Сумою випадкових подій А та В називається складна подія коли реалізується або А або В . Для взаємно виключних подій ймовірність суми дорівнює сумі ймовірностей реалізації кожної з них:
Якщо реалізуються і подія А і подія В , то кажуть про добуток подій . Ймовірність добутку незалежних подій дорівнює добутку ймовірностей реалізації кожної з них:
Випадковою величиною називається величина, яка може приймати ті чи інші значення в однакових умовах досліду. Випадкові величини задаються розподілом ймовірностей їх реалізації на спектрі дозволених значень величини :
Якщо спектр дозволених значень випадкової величини суцільний, то ймовірність dp ( x ) мати значення в межах (x , x + dx ) вважається пропорціональною величині інтервалу:
густина ймовірності мати це конкретне значення випадкової величини х . Випадкові величини з суцільним спектром дозволених значень задаються густиною ймовірностей їх реалізації, яка носить назву функції розподілу :
Ймовірність отримати довільне з дозволених значень – це достеменна подія, тому
Умова (6.7) називається умовою нормування . Ймовірність мати значення випадкової величини в межах (x1 , x2 ) визначається інтегралом:
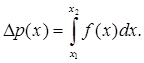 (6.8)
(6.8)Середні значення досліджуваної величини та довільної функції від неї знаходяться за такими формулами:
Таким чином, всі відомості про систему будуть отримані, якщо відома функція розподілу (6.6). Тому в статистичній фізиці стан термодинамічної системи задається функцією розподілу . Побудова функції розподілу є одним з головних завдань статистичної фізики. Вона будується, як правило, виходячи з загальних міркувань, теорії математичної статистики та конкретних припущень про природу та характер руху структурних елементів системи. В залежності від природи „молекул” системи існує класична статистика – для класичних молекул, та квантова статистика – для термодинамічних систем з квантових об’єктів.
2 Максвелівський розподіл молекул за швидкостями. Середньостатистичні значення швидкостей руху молекул та їх взаємозв’язок
Функцію розподілу молекул ідеальних класичних газів рівноважної термодинамічної системи вперше поставив та розв’язав англійський дослідник Дж. Кл. Максвел в 1859 році.
Розглядається рівноважний стан ідеального газу , що не знаходиться під дією зовнішніх сил. Параметри стану, в тому числі і концентрація молекул у всіх точках системи однакові . Рух молекул абсолютно хаотичний, всі напрямки руху молекул абсолютно рівноправні, проекції швидкостей руху молекул незалежні одна від одної . Після встановлення рівноважного хаотичного руху процесами взаємного зіткнення молекул можна нехтувати. Останнє положення Максвелом приймалось на віру і було обґрунтоване теоретично пізніше Л.Больцманом.
Виходячи з таких положень Максвел, використовуючи методи математичної статистики, отримав функції розподілу молекул за проекціями швидкостей:
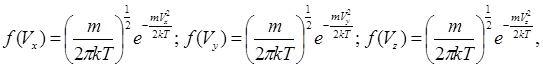 (6.10) де
(6.10) де  є нормуючий коефіцієнт.
є нормуючий коефіцієнт.Виходячи з положення про незалежність проекцій швидкостей, та з положення теорії ймовірностей про множення ймовірностей випадкових величин (6.3), отримаємо функцію розподілу молекул за швидкостями (тобто густину ймовірності мати конкретне значення вектора швидкості, або одночасно мати всі три проекції швидкості):
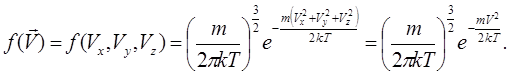 (6.11)
(6.11)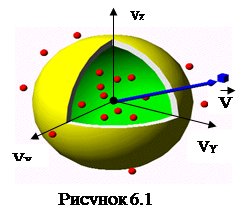
На практиці дослідника цікавить розподіл за модулями швидкостей , що і носить назву максвелівського розподілу або розподілу молекул за швидкостями . Для переходу від розподілу молекул за проекціями швидкостей до розподілу за модулями швидкостей використовується положення про рівноправність всіх напрямків руху молекул та прийом, пов’язаний з використанням так званих фазових просторів зображення стану рівноважної термодинамічної системи, де кожна точка фазового простору. У загальному випадку це 6 N -мірний простір координат та імпульсів (або швидкостей), де N – загальна кількість молекул. У конкретному випадку розгляду рівноважного ідеального газу не підлеглого впливу зовнішніх сил, фазовий простір зводиться до тривимірного простору швидкостей. У такому просторі кожна точка визначає швидкість молекул
являє собою функцію розподілу за векторами швидкостей. Зважаючи на абсолютну хаотичність руху молекул розглядуваного газу та на рівноправність всіх напрямків їх руху, можна стверджувати, що густина молекул у всіх точках (виділеного на рис. 6.1l двома вставленими одна в одну сферами радіусами Vта V+dV) сферичного шару, модулі швидкостей для якого знаходяться в межах (V,V+dV), одна і та ж саме:
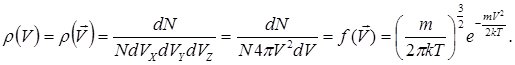 (6.12)
(6.12)Таким чином, функція розподілу молекул за швидкостями по їх модулях
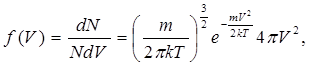 (6.13)
(6.13)як це слідує із співвідношення (6.12).
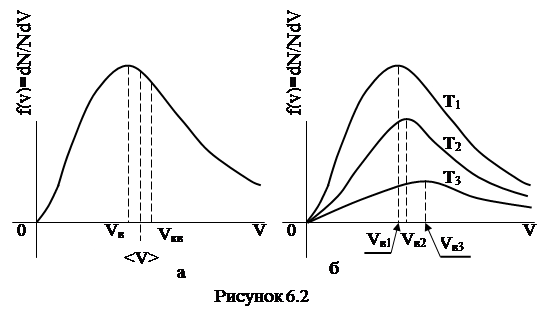 |
представлений на рис. 6.2.
|
На рис. 6.2 а представлений загальний вид графіка функції Максвела, а на рис. 6.2 б демонструється залежність ходу функції від температури газу. Т1
 (6.14)
(6.14)Якщо температура газу зростає до нескінченості функція розподілу співпаде з віссю швидкостей, тобто всі швидкості від нуля до нескінчено великої будуть рівно представлені. Навпаки, коли температура газу прагнутиме до абсолютного нуля, швидкості всіх молекул стануть нульовими. Найбільш ймовірною швидкістю є швидкість V в , що відповідає максимуму функції (6.13) (див. рис. 6.2). Дослідження на максимум функції (6.13) дає результат:
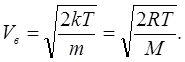 (6.15)
(6.15)Середня арифметична швидкість та квадрат середньої квадратичної швидкостей знаходяться за формулами (6.9):
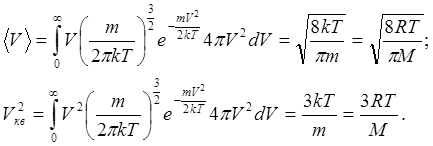 (6.16)
(6.16)Середня квадратична швидкість, як це випливає з другого співвідношення (6.16):
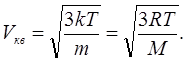 (6.17)
(6.17)Всі ці три статистичні характеристики представлені на рис. 6.2 і відносяться між собою як
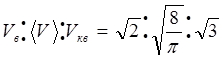 . (6.18)
. (6.18)3. Термодинаміка. Перший закон термодинаміки
1 Термодинамічна система. Внутрішня енергія термодинамічної системи. Робота та кількість теплоти. Перший закон термодинаміки
Термодинамічний метод, як на це було вказано вище, досліджує термодинамічні системи не цікавлячись їх будовою. З точки зору термодинаміки термодинамічною системою називається макроскопічна система, що вивчається методами термодинаміки. Всі тіла, не включені в термодинамічну систему, називаються зовнішнім середовищем .
Основним поняттям при вивченні термодинамічних систем є внутрішня енергія . Перший закон термодинаміки стверджує : існує внутрішня енергія термодинамічної системи - така однозначна функція параметрів її стану, зміна якої дорівнює роботі, виконаної над системою та кількості підведеної теплоти .
Робота і теплота це дві форми зміни внутрішньої енергії термодинамічних систем. Роботою називається фізична величина, що характеризується зміною внутрішньої енергії термодинамічної системи за рахунок переміщень макрочастин системи або всієї системи в цілому. В подальшому розглядається тільки такі процеси, в яких внутрішня енергія визначається тільки її внутрішнім станом. Кількість теплоти це фізична величина, що є мірою зміни внутрішньої енергії в процесах, що не супроводжуються виконанням роботи, в процесах де хаотичний рух переходить від одних тіл в хаотичний рух інших, від однієї частини системи до іншої без виконання роботи.
Молекулярна фізика дає тлумачення внутрішньої енергії як суми кінетичних енергій всіх молекул та потенціальної енергії їх взаємодії. В подальшому розглядаються тільки такі процеси, в яких не відбувається перетворень молекул, атомів або їх ядер. Енергія, як завжди, визначається з точністю до адитивної константи, тому всі види енергії вказаних джерел вводяться в константу, яка приймається нульовою. Внутрішня енергія ідеальних газів складається тільки з кінетичної енергії руху молекул і дорівнює [див. рівність (5.20)]
В термодинаміці внутрішню енергію частіше позначають літерою U , тому приймемо його. Кількість теплоти та робота відповідно позначаються літерами Q таA .
За звичаєм під роботою розуміють роботу виконану не над системою, а системою проти зовнішніх сил. Тому перший закон термодинаміки стверджує, що кількість підведеної до термодинамічної системи теплоти витрачається на зміну її внутрішньої енергії та на роботу проти зовнішніх сил:
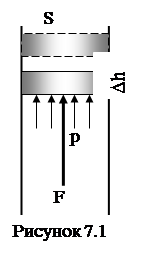
Робота ідеального газу проти зовнішніх сил пов’язана тільки із зміною об’єму. Дійсно (див. рис 7.1), робота сили внутрішнього тиску газу
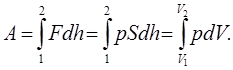 (7.3)
(7.3)Робота на діаграмі „р‑V” зображається площею під графіком функції p(V) (див. рис 5.1 a).
Внутрішня енергія є однозначною функцією стану системи, тому нескінчено мала її зміна є повним диференціалом dU . Робота та кількість теплоти, навпаки, залежать від форми переходу між станами і не є повними диференціалами, тому це dА та dQ. Диференціальна форма першого закону термодинаміки записується так:
2 Теплоємність тіл. Застосування першого закону термодинаміки до ізопроцесів. Теплоємність ідеальних газів в ізопроцесах
Досвід вчить, що кількість теплоти, підведеної до системи, прямо пропорційна різниці температур системи:
Q = С (Т2 - Т1 ) (7.5)
де Т1- початкова, а Т2- кінцева температури системи; С - постійний для системи коефіцієнт, що носить назву теплоємності системи. Якщо система є однорідне тіло, її теплоємність пропорційна масі тіла:
С = с m, (7.6)
де с - питома теплоємність речовини тіла: m - маса тіла; а також пропорційна кількості речовини тіла:
С = См n , (7.7)
де См- молярна теплоємність речовини тіла, а n кількість молів речовини тіла,
де m - маса тіла; M - молярна маса речовини.
Таким чином,
Відповідно до рівняння (7.9) теплоємності тіла визначаються за такими формулами:
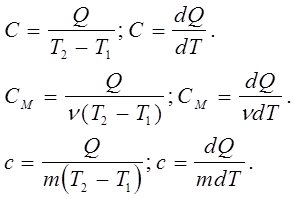 (7.10)
(7.10)Розглянемо особливості застосування першого закону термодинаміки до ізопроцесів в ідеальних газах.
Класична теорія теплоємності базується на теоремі про рівномірний розподіл енергії по ступенях свободи термодинамічної системи яка дозволяє обчислити внутрішню енергію ідеального газу [див. формулу (7.1)].
Робота ідеального газу проти зовнішніх сил зводиться тільки до роботи зміни його об’єму [див. формулу (7.3)]:
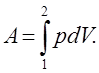 (7.11)
(7.11)Робота зміни об’єму ідеального газу залежить від виду газового процесу, тому елементарна робота d А не є повним диференціалом.
В ізохорному процесі V = const , тому d А = РdV = 0 і
В ізотермічному процесі Т = const , тому D U = 0 і
В підінтегральному виразі є дві змінні. Скориставшись рівнянням стану ідеального газу (5.8), виразимо, наприклад, Р через об’єм V і одержимо:
Відомо, що ізотермічний процес підкоряється закону Бойля-Маріотта:
P1 V1 = P2 V2, тому для нього
В ізобарному процесі Р = const , тому для нього
і перший закон термодинаміки (7.10) з урахуванням рівняння (7.11) має вигляд:
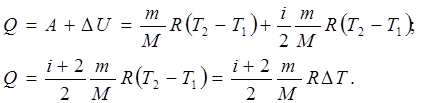 (7.16)
(7.16)Всі ізопроцеси досліджені для незмінної маси ідеальних газів:
m = const; М = const .
Відповідно до визначення теплоємностей (7.10) і співвідношень (7.13), (7.14), (7.16) для теплоємностей ідеальних газів маємо:
а) для ізохоричного процесу -
б) для ізотермічного процесу теплоємність не визначена і прямує до нескінченності -
в) для ізобарного процесу -
3. Адіабатичний процес. Внутрішня енергія та робота в адіабатичному процесі. Рівняння Пуасона
Крім названих вище процесів в термодинаміці до ізопроцесів відносять адіабатичний процес. Адіабатичним називається процес , що відбувається без теплообміну з довколишніми тілами. Для нього d Q = 0 і
тобто робота проти зовнішніх тіл відбувається за рахунок внутрішньої енергії. Для ідеального газу
Якщо роботу виконує система (А > 0) - вона охолоджується (Т2 < T1); якщо роботу в адіабатичному процесі виконують зовнішні сили над системою (А < 0) - система розігрівається (Т2 > Т1 ) . В диференціальній формі перший закон термодинаміки для адіабатичного процесу записується так:
Для отримання рівняння, що зв’язує параметри адіабатичного процесу, скористаємося диференціальною формою першого закону термодинаміки (7.22) та рівнянням стану ідеальних газів (5.8)
 (7.23)
(7.23)і поділимо ці співвідношення окремо ліві та праві частини:
Рівняння (7.24), як відомо, після інтегрування і потенціювання дає результат:
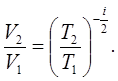 (7.25)
(7.25)Взагалі кажучи, інтегрування рівняння (7.24) повинно відбуватись з точністю до постійної інтегрування, яка, як це доводиться, може бути нульовою.
За домовленістю, в рівнянні (7.25) замість кількості ступіней вільності вживається інша величина, яка визначається як відношення теплоємностей в ізобарному та ізохорному процесах:
Відповідно, рівняння (7.25) приймає форму
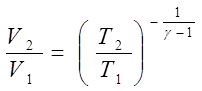 або
або Отримане рівняння носить назву рівняння Пуасона. Воно може бути представленим в інших формах шляхом використання об’єднаного газового закону (5.6):
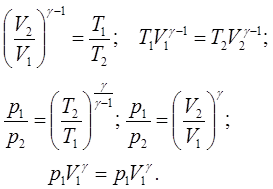 (7.28)
(7.28)Теплоємність тіла в адіабатичних процесах дорівнює нулю.
Вважається, що молекули повітря жорсткі диполі, тобто дві матеріальні точки жорстко зв’язані між собою (рис. 7.2).
Центр мас цієї системи має 3 координати (х, у, z ) - поступальні ступені свободи; система може обертатись довкола осей Ох і Оz - два ступеня свободи. Обертанням довкола власної осі (вісь Оу) нехтуємо, тому що атоми вважаються матеріальними точками. Відповідно для повітря теоретичне значення відношення теплоємності при постійному тиску до теплоємності при постійному об’ємі g = 1,4 .Графік адіабатичного процесу ідеальних газів, що носить назву адіабати (рис. 7.3) іде більш круто ніж ізотерма.
1 2 3