
Ім'я файлу: D0 руководство по СМА (Баку_ 2011[1].03.24.).docx
Розширення: docx
Розмір: 1130кб.
Дата: 14.01.2022
скачати
Розширення: docx
Розмір: 1130кб.
Дата: 14.01.2022
скачати
Вопросы для подготовки к коллоквиуму
| | |
| 1. | Обоснуйте квазинепрерывную широкополосную структуру оптических молекулярных абсорбционных спектров. Перечислите способы повышения дискретности этих спектров. |
| 2. | Что такое раствор сравнения в спектрофотометрическом анализе? Каков его состав и назначение? |
| 3. | В чём различие между истинным и средним молярным коэффициентом поглощения? Почему экспериментально измеренные значения молярных коэффициентов поглощения могут отличаться от истинных? |
| 4. | Почему с ростом коэффициента поглощения чувствительность спектрофотометрического определения, как правило, увеличивается? Ответ поясните графически. |
| 5. | Почему чувствительность спектрофотометрического метода заметно ниже чувствительности атомно-абсорбционного метода? |
| 6. | Перечислите требования к органическому реагенту при проведении фотометрической реакции. |
| 7. | Можно ли существенно повысить чувствительность спектрофотометрического определения веществ увеличением толщины кюветы? |
| 8. | Как меняется вид градуировочной зависимости оптической плотности от концентрации с ростом интенсивности рассеянного излучения? |
| 9. | Зависит ли чувствительность спектрофотометрического определения от мощности источника излучения? Почему? |
| 10. | Укажите причины положительных и отрицательных отклонений от закона Бугера-Ламберта-Бера в области больших концентраций поглощающего вещества. |
| 11. | Почему рабочий диапазон оптических плотностей спектрофотометра не превышает 1,5 – 2 порядков? |
| 12. | Укажите и обоснуйте преимущества дифференциального спектрофотометрического метода по сравнению с абсолютным. |
| 13. | Изложите сущность процедуры градуирования измерительной шкалы прибора в методе абсолютной и дифференциальной спектрофотометрии. |
| 14. | При каких длинах волн следует измерять оптическую плотность растворов при спектрофотометрическом анализе смесей веществ, если их спектры поглощения накладываются друг на друга? |
| 15. | Как можно повысить селективность фотометрической методики? |
| 16. | Перечислите законы, используемые при выполнении спектрофотометрического анализа однокомпонентной системы, определении нескольких компонентов при совместном присутствии, нахождении константы химического равновесия в растворе. |
| 17. | Представьте графически и сравните зависимости поглощения, пропускания, оптической плотности и коэффициента поглощения на выбранной длине волны от концентрации поглощающего вещества в растворе и толщины используемой кюветы. |
2.2. Флуориметрический метод анализа
Все вещества при нагревании испускают электромагнитное излучение, причём количество лучистой энергии увеличивается с ростом температуры. Однако некоторые вещества способны излучать свет как при комнатной, так и при более низкой температуре после нетеплового (радиационного, ультразвукового, биохимического и др.) возбуждения. Этот процесс называют люминесценцией. Неравновесное люминесцентное излучение представляет собой избыток над тепловым излучением вещества, т.е. над тем количеством лучистой энергии, которое оно может испустить при данной температуре в термодинамически равновесных условиях. Особого упоминания заслуживает фотолюминесценция, обусловленная возбуждением молекул органических и неорганических веществ электромагнитным излучением УФ и видимого диапазонов длин волн. Соответствующая разновидность люминесцентного (или флуориметрического) метода нашла широкое применение в аналитической химии во второй половине прошлого века. Серьёзный вклад в становление метода внесли советские физики С.И Вавилов, В.Л. Лёвшин и др.
2.2.1. Физические основы
Фотолюминесценция вещества представляет собой сложный процесс, состоящий из нескольких стадий. Две важные с экспериментальной точки зрения стадии – зондирование вещества и его отклик – следует выделить особо. Сначала в результате поглощения первичного фотона увеличивается внутренняя энергия молекулы. На заключительном этапе при излучательной релаксации молекула избавляется от большей части полученной энергии, рождая вторичный фотон. Наличие этих двух стадий роднит флуориметрический метод как с абсорбционными, так и эмиссионными методами. Поэтому для описания процесса фотолюминесценции вещества необходимо измерить не один, а два спектра – поглощения (возбуждения) и испускания. Отличаются ли они от абсорбционных и эмиссионных спектров свободных атомов в газовой фазе?
Внутренняя энергия атома определяется только энергией связанных электронов. Поэтому изменение этой энергии при поглощении или испускании фотона сопровождается лишь электронными квантовыми переходами. Оптические спектры свободных атомов имеют дискретную структуру, в которой каждому переходу соответствует отдельная линия. Положение абсорбционной линии в спектре совпадает с положением соответствующей эмиссионной линии атомов данного элемента. Частичная потеря избыточной внутренней энергии при безызлучательной релаксации в случае столкновения атомов не приводит к смещению линий в спектре.
У молекулы больше степеней свободы. Ядра входящих в её состав атомов могут совершать колебательное и вращательное движение друг относительно друга. Поэтому внутренняя энергия молекулы складывается из трёх составляющих, а её изменение при поглощении или испускании фотона сопровождается комбинированными электронно-колебательно-вращательными переходами. Различие природы и взаимосвязь этих составляющих обусловливает возможность как независимого изменения, так и взаимного перехода одного вида внутренней энергии в другой. Поэтому широкополосные (см. раздел 2.1.1.) молекулярные спектры поглощения и испускания вещества в конденсированной фазе должны заметно отличаться. После поглощения оптического фотона за время порядка
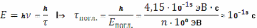
молекула приобретает избыточную энергию, как правило, не только электронную, но и колебательную. Избавится от избытка электронной энергии молекула может, испустив вторичный оптический фотон в результате разрешённого (!) излучательного перехода. Данный вид люминесценции называют флуоресценцией. Время жизни возбуждённого электронного состояния атома и молекулы сопоставимо (10-8 с). Однако в конденсированной фазе в результате постоянного межмолекулярного взаимодействия и возмущения валентных орбиталей оно сокращается. Возбуждённая молекула может оказаться в основном электронном состоянии за счёт других квантовых переходов как излучательных, так и безызлучательных. В зависимости от природы люминофора, растворителя и температуры раствора время жизни возбуждённого электронного состояния и, соответственно, длительность флуоресценции изменяется в интервале 10-10 – 10-7 с.
Избавится от избытка колебательной энергии молекула может в результате безызлучательного квантового перехода. Колебательная релаксация – более эффективный процесс, чем флуоресценция. Непосредственная передача избытка внутренней энергии между молекулами люминофора и растворителя осуществляется за время сопоставимое с периодом колебания связанных атомов:
Следовательно, время жизни молекулы на возбуждённом колебательном уровне много меньше (на 3 – 6 порядков) среднего времени жизни возбуждённого электронного состояния. Поэтому ещё до начала флуоресцентной релаксации все возбуждённые молекулы люминофора оказываются на одном и том же (!) стационарном уровне – на нижнем колебательном уровне первого возбуждённого электронного состояния – независимо от количества энергии, полученной при поглощении первичного фотона. А это означает, что профиль спектра люминесценции не зависит от длины волны возбуждающего света (правило Каши). Главное, чтобы энергии фотона было достаточно для возбуждения связанного электрона.
Далее, при колебательной релаксации возбуждённых молекул люминофора часть поглощённой лучистой энергии обязательно переходит в тепловую, т.е. идёт на нагрев раствора:
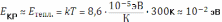
По закону сохранения, энергия испущенных молекулами вторичных (флуоресцентных) фотонов в среднем меньше энергии поглощённого (возбуждающего) излучения. Поэтому спектр люминесценции сдвинут относительно спектра поглощения в более длинноволновую (низкоэнергетическую) область (закон Стокса – Ломмеля). Эти спектры, как правило, частично накладываются друг на друга, что связано с конечной заселённостью нижних возбуждённых колебательных уровней основного электронного состояния молекулы люминофора при комнатной и даже более низкой температуре и, соответственно, возможностью поглощения молекулой фотона с энергией меньшей энергии «чистого» электронного перехода.
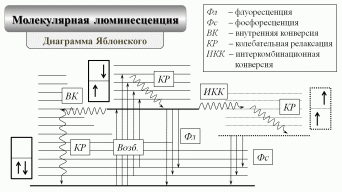
Флуоресценция не единственный вид излучательной релаксации. При понижении температуры раствора и увеличении вязкости растворителя время жизни возбуждённого электронного состояния молекулы люминофора возрастает, что способствует протеканию конкурирующего процесса перераспределения внутренней энергии с изменением спина возбуждённого электрона (интеркомбинационная конверсия). Эффективность данного процесса возрастает в присутствии растворённого кислорода, парамагнитных ионов переходных металлов и т.п. Теперь молекула люминофора может избавится от избытка электронной энергии, испустив вторичный оптический фотон в результате запрещённого (!) излучательного перехода. Этот вид люминесценции называют фосфоресценцией. Длительность свечения при этом возрастает до 10-4 – 102 с. Спектр фосфоресценции сдвинут в область меньших энергий (больших длин волн) относительно спектра флуоресценции.
Важной с аналитической точки зрения характеристикой люминесценции является квантовый выход. Это один из параметров, влияющих на чувствительность флуориметрического определения. Квантовый выход равен вероятности излучательной релаксации молекул люминофора после фотовозбуждения и принимает значения от нуля до единицы:
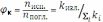
где nпогл. и nисп.– число поглощённых и испущенных фотонов. При альтернативном представлении в знаменателе дроби указано суммарное значение констант скоростей (ki) всех квантовых процессов с участием молекул люминофора, находящихся на основном колебательном уровне первого возбуждённого электронного состояния. В числителе дроби приведена константа скорости (kизл.) одного из процессов с испусканием вторичного фотона. При уменьшении температуры раствора люминофора на один градус по Цельсию квантовый выход флуоресценции возрастает на несколько процентов. Начиная с некоторой температуры, он перестаёт меняться, тогда как выход фосфоресценции становится отличным от нуля и быстро увеличивается. При дальнейшем снижении температуры суммарный выход флуоресценции и фосфоресценции стремится к единице.
Снижение квантового выхода называют тушением люминесценции. С увеличением температуры раствора интенсифицируется процесс взаимодействия молекул люминофора и растворителя, сопровождающегося возмущением орбиталей. В этих условиях заметно возрастает вероятность квантового перехода с перераспределением избыточной внутренней энергии. Возбуждённая молекула люминофора за время порядка 10-9 – 10-7 с переходит на высокий колебательный уровень основного (!) электронного состояния (внутренняя конверсия). После этого за 10-13 с она полностью теряет всю избыточную энергию по безызлучательному механизму колебательной релаксации. Описанный выше процесс называют температурным тушением люминесценции. С ростом концентрации люминофора в растворе уменьшается среднее расстояние между его молекулами и увеличивается частота актов межмолекулярного взаимодействия, сопровождающегося прямой безызлучательной передачей избыточной внутренней энергии от одной молекулы к другой, а также образованием нелюминесцирующих молекулярных димеров. Данный процесс, который называют концентрационным тушением люминесценции, ограничивает диапазон определяемых концентраций люминофоров сверху на уровне примерно 10-4 М.
Зависит ли квантовый выход люминесценции от длины волны первичного и вторичного электромагнитного излучения? Чтобы релаксация возбуждённой молекулы люминофора могла закончиться испусканием оптического фотона, она должна обладать избытком электронной энергии. Конечно, спектр поглощения неоднороден, и фотоны различной энергии поглощаются молекулой люминофора с разной эффективностью. Но если энергия поглощаемых фотонов больше энергии «чистого» электронного перехода, каждый акт поглощения ведёт к увеличению электронной составляющей внутренней энергии. Из правила Каши следует, что эффективность излучательной релаксации никак не связана с энергией возбуждающего излучения, Поэтому квантовый выход не должен значимо меняться при изменении длины волны первичного излучения. Если энергия фотона меньше энергии «чистого» электронного перехода, то доля актов поглощения, сопровождающихся изменением электронной энергии молекулы люминофора, ничтожно мала и определяется заселённостью возбуждённых колебательных уровней основного электронного состояния. При этом с уменьшением энергии фотона (увеличением длины волны) вероятность электронного перехода быстро убывает, поскольку заселённость возбуждённых колебательных уровней экспоненциально падает с ростом их энергии. Таким образом, фотолюминесценция может сохранять постоянный квантовый выход, если возбуждающая волна преобразуется, в среднем, в более длинную, чем она сама. Напротив, выход фотолюминесценции резко уменьшается при обратном превращении длинных волн в короткие (закон Вавилова).
Квантовый выход люминесценции (вероятность излучательной релаксации), интенсивность первичного излучения и молярный коэффициент поглощения (эффективность возбуждения молекул люминофора) входят в качестве параметров в уравнение связи интенсивности люминесценции с концентрацией люминофора (см. описание к работе №11). Данное выражение является основанием количественного флуориметрического анализа.
2.2.2. Аппаратурное оформление
Спектр фотолюминесценции представляет собой волновое распределение интенсивности вторичного излучения, испущенного молекулами люминофора, при фиксированной длине волны первичного (возбуждающего) излучения. Для повышения чувствительности определения спектр обычно измеряют при длине волны максимума наиболее интенсивной полосы поглощения. Для минимального искажения спектра рассеянным первичным излучением (особенно при низких концентрациях люминофора в растворе) желательно выбирать длину волны возбуждающего излучения так, чтобы оно не накладывалось на спектр люминесценции.
| Блок-схема спектрофлуориметра | |||
| а б в г д е | – источник излучения (ламповый блок) – монохроматор первичного излучения – кюветное отделение – монохроматор вторичного излучения – система детектирования – регистрирующее устройство | ||
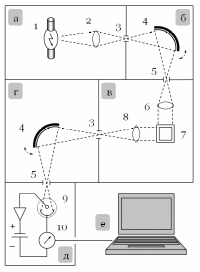 | 1 2,6,8 3 4 5 7 9 10 | – газоразрядная ксеноновая лампа – собирающие линзы – входная щель – дифракционная решётка – выходная щель – кювета с раствором люминофора – фотоумножитель – амперметр | |
Поскольку флуориметрический метод является силовым, в спектрофлуориметрах в качестве источника возбуждающего излучения используют газоразрядные ксеноновые лампы (или мощные лампы накаливания). Из непрерывного спектра источника излучения с помощью дифракционного монохроматора вырезают узкий интервал длин волн шириной 5 – 10 нм и направляют световой поток на кварцевую кювету с раствором люминофора. Вторичное излучение отбирают под углом 90°, чтобы минимизировать долю рассеянного первичного излучения, попавшего в детектор. Вторичное излучение раскладывают в спектр с помощью ещё одного дифракционного монохроматора. Поскольку интенсивность люминесценции невелика, в качестве детектора используют фотоэлектронный умножитель.
Чувствительность флуориметрического определения в значительной мере зависит от мощности источника возбуждающего излучения, а погрешность результатов анализа – от его стабильности. Для аппаратной компенсации возможных флуктуаций интенсивности часть потока первичного излучения после монохроматора (но до кюветного отделения!) направляют на фотоприёмник опорного канала. Интенсивность вторичного излучения, измеряемую фотоэлектронным умножителем, корректируют с учётом сигнала данного фотоприёмника в режиме реального времени.
Для измерения спектра поглощения (возбуждения) люминофора в некоторых моделях спектрофлуориметров устанавливают дополнительный детектор, измеряющий интенсивность первичного излучения, прошедшего через кювету с раствором. Однако классический способ основан на измерении зависимости интенсивности вторичного (люминесцентного) излучения на выбранной (фиксированной) длине волны от длины волны первичного (возбуждающего) излучения. Полученный при этом спектр эквивалентен спектру поглощения люминофора.
2.2.3. Аналитические возможности
Флуориметрический метод используют для определения довольно узкого круга веществ:
- соединений лантанидов и актинидов по собственной люминесценции (участвующие в излучательном переходе f-орбитали хорошо экранированы от внешних воздействий),
- ртутеподобных ионов (Tl(I), Sn(II), Pb(II) и др.) в виде галогенидных комплексов при охлаждении,
- некоторых комплексов Cu(I), Au(I) и платиновых металлов при охлаждении (участвующие в излучательном переходе d-орбитали экранированы от внешних воздействий заметно хуже, чем f-орбитали, однако вероятность безызлучательной релаксации снижается при понижении температуры),
- ионов непереходных металлов (Ca, Mg, Al и др.) в виде комплексов с люминесцирующими лигандами (производными 8-оксихинолина, оксиазометиновых соединений, полиоксифлавонами),
- органических веществ, молекулы которых имеют жёсткую структуру с большим числом сопряжённых кратных связей, например, полиароматических углеводородов, витаминов и др. (жёсткая структура молекулы резко снижает вероятность безызлучательной релаксации за счёт изгиба молекулярной цепи и вращения концевых групп).
По чувствительности (на уровне нескольких десятков пг/мл) флуориметрический метод превосходит спектрофотометрический на 2 – 4 порядка. Широкополосная структура спектров люминесценции обуславливает низкую селективность флуориметрического определения. Однако, используя некоторые технические приёмы (например, синхронную флуориметрию), удаётся раздельно определить несколько люминесцирующих соединений при их совместном присутствии в анализируемом объекте.
Практические работы
Работа №10. Проверка правила зеркальной симметрии спектров поглощения и флуоресценции рибофлавина
В разделе 2.2.1. было отмечено, что спектр флуоресценции сдвинут относительно спектра поглощения (возбуждения) люминофора в область меньших энергий (больших длин волн). Есть ли что-то общее в структуре этих спектров? Время жизни возбуждённого электронного состояния молекулы достаточно велико (до 10-7 с), однако длительность самого излучательного перехода пренебрежимо мала по сравнению с периодом колебания атомов в молекуле. За время квантового перехода среднее расстояние между ядрами связанных атомов не успевает значимо измениться (принцип Франка – Кондона). Поэтому структура колебательных уровней основного и возбуждённого электронного состояния молекулы люминофора оказывается идентичной. В результате каждая полоса спектра поглощения (возбуждения) люминофора сдвинута относительно полосы «чистого» электронного перехода в область больших энергий, а аналогичная полоса спектра люминесценции – в область меньших энергий. Причём в обоих спектрах величина сдвига одинакова по величине (!) и равна энергии соответствующего колебательного уровня молекулы. Поэтому спектры поглощения и люминесценции зеркально симметричны относительно прямой, перпендикулярной оси частот и проходящей через точку пересечения спектров v0 (правило Лёвшина):
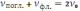
где vпогл. и vфл. – симметричные частоты поглощения и флуоресценции. Приведённую формулу легко преобразовать к виду
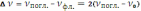
Если на оси абсцисс откладывать значения vпогл., а на оси ординат – значения v, то при зеркальной симметрии спектров поглощения и флуоресценции должна получиться прямая с тангенсом угла наклона, равным двум. Эта закономерность наблюдается только для сложных молекул люминофора с жёсткой структурой, не склонных
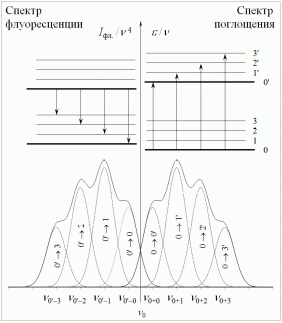
к димеризации. Кроме того, спектры необходимо нормировать и представлять в координатах /v(v) и Iфл./v4 (v), где v – частота излучения, – молярный коэффициент поглощения, Iфл. – интенсивность флуоресценции. Выбор системы координат обусловлен функциональной связью между значениями квантово-механической вероятности абсорбционного и эмиссионного переходов между двумя любыми стационарными уровнями (см. формулу в разделе 1).
Из приведённого выше рассуждения следует, что нормированные спектры поглощения и флуоресценции должны пересекаться при частоте «чистого» электронного перехода. Однако на практике этого не происходит, и между максимумами полос, соответствующих данному переходу в обоих спектрах, наблюдается закономерный сдвиг. Дело в том, что в растворе энергии основного и возбуждённого электронного состояний зависят от направления перехода. При поглощении фотона за время порядка 10-15 с электронное облако расширяется, что способствует увеличению поляризуемости молекулы люминофора и изменению её дипольного момента. В соответствие с принципом Франка – Кондона, примерно за 10-10 с происходит переориентация окружающих молекул растворителя. На это уходит часть поглощённой энергии фотона, и в результате перераспределения зарядов возбуждённый электронный уровень понижается. После флуоресцентной релаксации за 10-10 – 10-7 с электронное облако опять сжимается, поляризуемость молекулы люминофора уменьшается. Изменение её дипольного момента ведёт к вторичной переориентации молекул растворителя. На перераспределение зарядов в окрестности молекулы люминофора затрачивается часть её внутренней энергии, что ведёт к снижению основного электронного уровня. Величина сдвига между максимумами полос, соответствующих «чистому» электронному переходу в спектрах поглощения и флуоресценции люминофора возрастает от единиц нм до нескольких десятков нм при понижении жёсткости структуры молекулы, увеличении полярности растворителя и повышении температуры раствора. Поэтому, в общем случае, правило зеркальной симметрии Лёвшина выполняется лишь приблизительно.
Измерение спектров поглощения и люминесценции представляет не только теоретический, но и практический интерес. Изучение этих спектров – обязательный этап оптимизации условий количественного флуориметрического анализа (выбор растворителя, кислотности и фонового состава раствора, длины волны первичного и вторичного излучения и т.д.). Настоящая работа посвящена проверке правила зеркальной симметрии Лёвшина после измерения и последующей математической обработки спектров поглощения и флуоресценции уксуснокислого раствора рибофлавина.
Рибофлавин (витамин В2, С17Н20N4O6, М.м. 376,37 г/моль) является биологически активным веществом, играющим важную роль в поддержании здоровья человека. Витамин B2 необходим для образования красных кровяных телец, антител, регуляции роста, нормального функционирования щитовидной железы и репродуктивных органов.
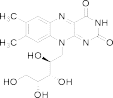
Биологическая роль рибофлавина определяется вхождением его производных — коферментов — флавинмононуклеотида (ФМН), флавинадениндинуклеотида (ФАД) и флавинадениндииуоклеотида в состав большого числа важнейших окислительно-восстановительных ферментов. Препараты рибофлавина и ФМН применяют для профилактики и лечения недостаточности витамина B2, при кожных заболеваниях, вяло заживающих ранах, заболеваниях глаз, нарушении функции желудочно-кишечного тракта, диабете, анемиях, циррозе печени.
Реагенты и аппаратура
Стандартный раствор рибофлавина 10 мкг/мл.
Спектрофлуориметр «Флюорат-02-Панорама».
Кварцевые кюветы, l = 1 см.
Выполнение определения
Измеряют интенсивность флуоресценции стандартного раствора рибофлавина в диапазоне длин волн 450 – 650 нм и определяют положение макс флуоресценции. Используя результаты измерений, а также данные представленные в таблице (см. ниже), на одном графике строят нормированные спектры поглощения и флуоресценции рибофлавина в координатах /v(v) и Iфл./v4 (v), соответственно.
Спектр поглощения рибофлавина (с = 12,5 мкг/мл=33 мкМ, l = 1 см)
| , нм | 400 | 410 | 420 | 430 | 435 | 440 | 445 | 450 |
| А | 0,296 | 0,302 | 0,327 | 0,352 | 0,363 | 0,371 | 0,375 | 0,367 |
| , нм | 455 | 460 | 465 | 470 | 480 | 490 | 500 | 510 |
| А | 0,351 | 0,333 | 0,313 | 0,288 | 0,214 | 0,125 | 0,060 | 0,031 |
По точке пересечения обоих спектров определяют значение v0. Проверяют выполнение правила зеркальной симметрии, построив график зависимости v = vпогл. – vфл. от vпогл.. Если при этом получится прямая с тангенсом угла наклона 2, то правило зеркальной симметрии соблюдается.
Работа №11. Определение рибофлавина в инъекционном растворе способом градуировочного графика
Для проведения количественного флуориметрического анализа необходимо установить функциональную связь между интенсивностью флуоресценции раствора люминофора (Iфл.) и его концентрацией (c). Допустим, что аналитический сигнал формирует истинный нерассеивающий раствор, помещённый в кубическую кювету с длиной ребра l. Расположим кювету в прямоугольной системе координат (x, y, z). Плоскопараллельный пучок первичного излучения с длиной волны 0 интенсивностью I0 проходит сквозь кювету вдоль оси x. Вторичное излучение люминофора с длиной волны фл. отбирается под прямым углом к потоку возбуждающего света вдоль оси y. На расстоянии x от стенки кюветы интенсивность флуоресцентного излучения испущенного элементарным объёмом раствора dV=dxdydz пропорциональна
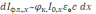
где к. – квантовый выход флуоресценции, 0 – коэффициент поглощения первичного излучения люминофором. При прохождении сквозь раствор интенсивность первичного излучения уменьшается за счёт поглощения молекулами люминофора и сопутствующими компонентами (эффект внутреннего фильтра). По закону Бугера – Ламберта:
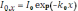
где k0 – коэффициент экстинкции раствора для первичного излучения. Этот коэффициент, по закону Бера, пропорционален концентрации поглощающих частиц (ci). Принимая во внимание закон Фирордта:
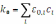
где 0,i – коэффициент поглощения возбуждающего излучения i-м компонентом. Возникшее в элементарном объёме раствора dV флуоресцентное излучение ослабляется в направлении детектора при прохождении через слой раствора толщиной y, вследствие поглощения молекулами люминофора и сопутствующими компонентами (эффект реабсорбции):
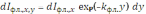
где kфл. – коэффициент экстинкции раствора для вторичного излучения
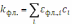
а фл.,i – коэффициент поглощения флуоресцентного излучения i-м компонентом. Полную интенсивность вторичного излучения можно получить, интегрируя по всему объёму раствора люминофора:


Используя основной закон поглощения света и базовые соотношения для оптической плотности (A) и пропускания (T) раствора, данное выражение можно переписать следующим образом:
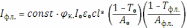
Константа в правой части уравнения учитывает, в первую очередь, аппаратные факторы – долю флуоресцентного излучения, попавшего в монохроматор, пропускание спектрометра, эффективность детектирования и др.
Если раствор люминофора слабо поглощает первичное и вторичное излучение и k0l и kфл.l < 0,05 , т.е. эффекты внутреннего фильтра и реабсорбции практически не выражены, формула для интенсивности флуоресцентного излучения значительно упрощается:
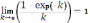
поэтому

Цель данной работы – флуориметрическое определение содержания рибофлавина в инъекционном растворе. Для выполнения работы необходимо выбрать длины волн первичного и вторичного излучений, построить градуировочный график и с его помощью определить содержание рибофлавина в анализируемом растворе.
Реагенты, аппаратура, посуда
Стандартный раствор рибофлавина 10 мкг/мл.
Раствор рибофлавина мононуклеотида в инъекциях (ампулы).
Спектрофлуориметр «Флюорат-02-Панорама».
Кварцевые кюветы, l = 1 см.
Мерные колбы ёмкостью 25,0.
Пипетки, 1,00; 2,00 и 5,00 мл.
Выполнение определения
На основании спектров поглощения и флуоресценции, измеренных в предыдущей работе выбирают оптимальные длины волн возбуждения и измерения интенсивности флуоресценции. В пяти мерных колбах ёмкостью 25,0 мл готовят серию растворов рибофлавина с содержанием (мкг/мл): 0,2; 0,4; 0,6; 0,8 и 1,0. Следует уделить особое внимание чистоте используемой посуды и кювет. Мерные колбы тщательно промывают раствором соды, а кюветы концентрированной соляной кислотой (под тягой), после чего многократно ополаскивают их водопроводной и два раза дистиллированной водой. Измеряют интенсивность флуоресценции контрольного опыта (дистиллированная вода) и растворов стандартной серии в порядке увеличения концентрации люминофора (длина оптического пути – 1 см). По полученным данным строят градуировочный график в координатах интенсивность флуоресценции – концентрация рибофлавина, мкг/мл. Анализируемый инъекционный раствор в мерной колбе ёмкостью 25,0 мл разбавляют до метки дистиллированной водой и тщательно перемешивают. Содержание рибофлавина в анализируемом растворе находят по градуировочному графику, измерив интенсивность его флуоресценции. В заключение проводят 10 измерений интенсивности флуоресценции раствора контрольного опыта и рассчитывают предел обнаружения (сmin) методики определения рибофлавина по 3s-критерию:
 ,
,где s0 – стандартное отклонение результатов контрольного опыта (n = 10), S – среднее значение крутизны градуировочного графика. Величину предела обнаружения выражают в мкг/мл и моль/л.
Вопросы для подготовки к коллоквиуму
| | |
| 1. | Укажите особенности молекулярной структуры (электронного строения) органических (неорганических) люминофоров. |
| 2. | Что такое спектры возбуждения и флуоресценции? Дайте определение. |
| 3. | В чём состоят основные различия между двумя видами молекулярной люминесценции – флуоресценцией и фосфоресценцией? |
| 4. | На одном рисунке изобразите спектры поглощения, флуоресценции и фосфоресценции одного и того же люминофора. Объясните их взаимное расположение при помощи диаграмм Яблонского. |
| 5. | Какая область спектра флуоресценции – коротковолновая или длинноволновая – подвержена наибольшим искажениям вследствие самопоглощения (реабсорбции). Ответ поясните графически. |
| 6. | Какую информацию может извлечь химик-аналитик из спектров возбуждения (поглощения) и флуоресценции при разработке методики определения люминофора в растворе? |
| 7. | Зависит ли форма спектра флуоресценции от энергии возбуждающего излучения? Обоснуйте ответ. |
| 8. | Приведите уравнение, связывающее квантовый и энергетический выходы люминесценции. Какая из указанных величин больше? Поясните физический смысл полученного математического выражения. |
| 9. | Перечислите основные требования, предъявляемые к источнику излучения в молекулярной люминесцентной спектроскопии. |
| 10. | В каком методе анализа – спектрофотометрическом или люминесцентном – флуктуации интенсивности источника излучения сильнее сказываются на погрешности измерения аналитического сигнала? |
| 11. | Почему в люминесцентном анализе увеличение мощности источника излучения не всегда сопровождается пропорциональным ростом чувствительности определения люминофора? Какой фактор ограничивает чувствительность флуориметрических методик определения? |
| 12. | Сравните оптическую схему спектрофотометра и спектрофлуориметра. Почему интенсивность люминесценции, как правило, измеряют под углом 90 к направлению распространения возбуждающего излучения? |
| 13. | Что понимают под тушением люминесценции? Перечислите основные причины, вызывающие это явление. |
| 14. | Как и почему влияет температура на интенсивность молекулярной люминесценции? |
| 15. | Почему на спектрофлуориметрах без полноценного монохроматора возбуждающего излучения устанавливают абсорбционные светофильтры, поглощающие длинноволновую часть спектра источника излучения? |
| 16. | Назовите причины нелинейных искажений градуировочной зависимости в люминесцентном анализе в области малых и больших концентраций. |
| 17. | Назовите способы повышения селективности флуориметрического метода. |
| 18. | Сравните и объясните различия аналитических возможностей люминесцентного и спектрофотометрического методов. |
Приложение
7. Спектральное оборудование для выполнения практических работ
7.1. Пламенный фотометр Jenway PFP7
Пламенный фотометр JENWAY PFP7 предназначен для измерения интенсивности характеристического излучения атомов и ионов щелочных и щелочноземельных металлов в видимой области спектра при возбуждении в пламени газовой горелки, а также для определения концентрации указанных элементов в водных растворах после предварительной градуировки прибора.

7.1.1. Технические характеристики
| 1. | Определяемые элементы | Na, K (Li, Ca, Ba) |
| 2. | Рабочий диапазон концентраций, мкг/мл | Na: 0,2 – 1000 K: 0,2 – 400 |
| 3. | Значения длины волны эмиссионных линий, нм | Na: 589 (жёлтое пламя) K: 766 (фиолетовое пламя) |
| 4. | Монохроматор | Светофильтр |
| 5. | Приёмник излучения | Фотодиод |
| 6. | Горючий газ | Пропан (бутан) |
| 7. | Газ-окислитель | Воздух |
| 8. | Расход пробы, мл/мин | 2 – 6 |
7.1.2. Порядок работы
Состояние прибора перед проведением измерений
Вне помещения:
Вентиль на баллоне с пропаном закрыт.
Вентиль на редукторе открыт (от положения, когда шкала полностью «утоплена» в редуктор, нужно сделать 7 полных оборотов – по выдвигающейся шкале примерно 0,5 bar).
В лаборатории: