
Зберігання. У закупореній тарі.
Застосування. Для лікування ангіни, бешихи та інших кокових інфекцій.
4. Охарактеризуйте можливі методи кількісного визначення прокаїну гідрохлориду. Напишіть рівняння реакції; визначте молярну масу еквіваленту, титр титранта за досліджуваною речовиною, напишіть формулу розрахунку масової частки.
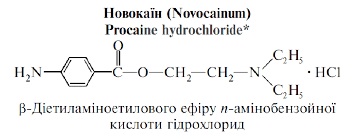
ПРОКАЇНУ ГІДРОХЛОРИД (Procaini hydrochloridum), 2-(діетиламіно)етил-4-амінобензоату гідрохлорид.
С13Н21ClN2О2 Мол. м. 272,8
Кількісне визначення: 1. Нітритометрія (див. анестезин), s = 1 .
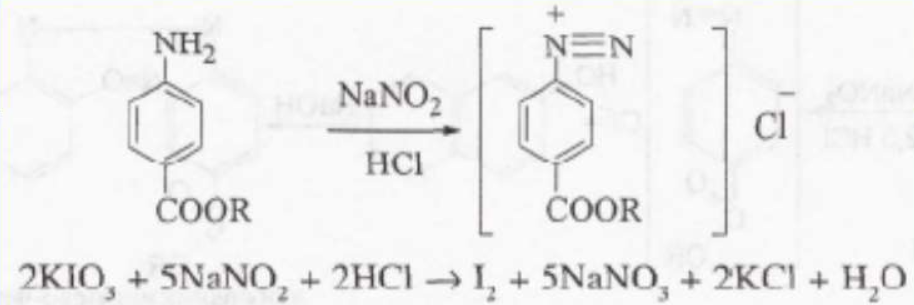
2. Алкаліметрія за зв'язаною кислотою хлористоводневою. Титрування ведуть у присутності хлороформу, який екстрагує основу, що виділяється, індикатор - фенолфталеїн, s = 1 .
3. Аргентометрія за пов'язаною кислотою хлористводневою, s = 1 .
5. Обгрунтуйте умови зберігання формаліну. З якою метою до формаліну добавляють метиловий спирт? Напишіть відповідні рівняння хімічних реакцій.
Формалі́н — водометанольний розчин Формальдегіду, безбарвна прозора рідина з різким подразнювальним запахом, що використовується як засіб для дезінфекції, фіксації, дублення тощо. Являє собою 40% водний розчин формальдегіду, який в якості стабілізатора містить близько 8% (6 – 15%) метилового (технічного) спирту. Медичний формалін, як розчин формальдегіду, відноситься до токсичних речовин класу ІІВ та здійснює нейротоксичний, нефротоксичний, гепатотоксичний та подразнюючий вплив на шкірні покрови і слизові оболонки дихальних шляхів. Формалін має здатність накопичуватися в організмі і проявляти властиві йому мутагенну і канцерогенну дію.
Формалін відноситься до другого класу небезпеки, так як в його складі присутні відразу два токсичних речовини. Вдихання парів формаліну може привести до важкого отруєння з подальшими серйозними ускладненнями, серед яких:
набряклість легенів, гортані, дихальна недостатність;
хронічне запалення нирок;
гормональний дисбаланс, безпліддя;
кома в результаті анурії.
Отруєння формаліном можна порівняти з отруєнням миш'яком. Якщо постраждалому не надати своєчасну допомогу, може наступити летальний результат. У ряді випадків при підвищеній концентрації формаліну в повітрі навіть при швидкому реагуванні врятувати пацієнта не вдається.
Використовується як консервант при зберіганні трупного матеріалу.
Зберігати медичний формалін необхідно в добре закупорених склянках, в захищених від світла місцях, з дотриманням температурного режиму 10 – 20 градусів вище нуля.
Відпрацьований формалін підлягає обов'язковій утилізації. Таку послугу можуть надавати тільки спеціалізовані компанії, які мають на це відповідну ліцензію. Порядок дій при утилізації формаліну наступний:
паркан відпрацьованого або простроченого речовини в спеціальні герметичні ємності;
транспортування до місця тимчасового зберігання або полігонів, майданчикам для утилізації;
знезараження токсичних речовин;
захоронення відходів, які більше не становлять небезпеки для оточення, або їх знищення за допомогою спеціального обладнання.
Для знезараження формаліну в більшості випадків застосовується біологічний метод детоксикації.
Додавання метилового спиртку до формальдегіду використовують з метою денатурації білків молекул.
Зі спиртами в присутності слідів кислоти формальдегід легко дає відповідні ацеталі, наприклад:
Ацеталь метилового спирту, так званий метилаль, або диметилформаль, СН2(ОСН3)2 являє собою рідину з ефірним запахом, що не змішується з водою (т. кіп. 41,5°С, відносна щільність 0,862 при 18° С); етилаль, або діетилформаль, СН2(ОС2Н5)2 кипить при 87 ° С і має відносну щільність 0,834 при 20 ° С.
6. Поясніть, з якими особливостями структури кислоти глутамінової пов'язано визначення її питомого обертання. З якою метою цей показник використовують в фармацевтичному аналізі?
L (+) -Глутамінова кислота ( - аміноглутарова кислота). Входить до складу багатьох білків та інших сполук ( глутатіону, фолієвої кислоти) у вигляді кислоти та її аміду — глутаміну:
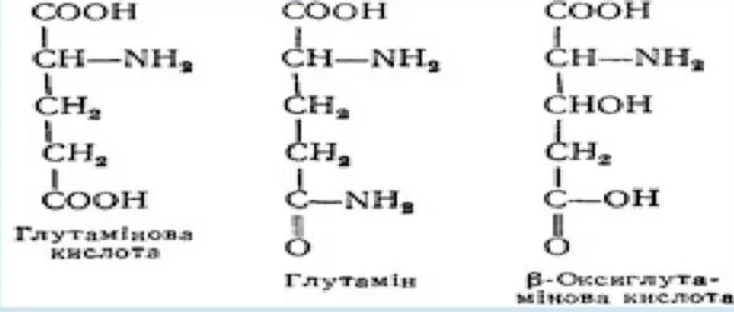
Амінокислота та її амід становлять 1/3 усіх вільних амінокислот плазми крові. Бере участь у реакціях переамінування, окислювального дезамінування, декарбоксилування амінокислот, в утворенні - аміномасляної кислоти, глутатіону, синтезі глюкози та орнітину. Глутамін зв'язує аміак тканин і транспортує його до місця детоксикації (у печінку та нирки). Кислота синтезується в організмі і утворюється під час гідролізу білків кормів. Використовується при лікуванні багатьох нервових хвороб (сировина для синтезу - аміномасляної кислоти). Особливо багато її в альбумінах і глобулінах крові, колагені.
Глутамінова кислота, як і решта амінокислот, є α-амінокислотою, що має центральний атом вуглецю (який є хіральним), α-вуглець, до якого приєднані ще чотири групи: карбоксильна група, аміногрупа, атом водню та група-заступник (бічний ланцюг або R-група).
R-група глутамінової кислоти дає молекулі другу карбоксильну групу (-COOH), а її структура є -CH2-CH2-COOH (-CH2-CH2-COO- в її іонізованій формі), отже сума атомів загальний вуглець молекули становить п’ять.
Ця амінокислота має відносну масу 147 г / моль, а константа дисоціації (рКа) її групи R становить 4,25. Він має ізоелектричну точку 3,22, а середній індекс присутності білка становить близько 7%.
Оскільки при нейтральному рН (близько 7) глутамінова кислота є іонізованою і має негативний заряд, вона класифікується в групі негативно заряджених полярних амінокислот, групи, до якої також входить аспарагінова кислота (аспартат, у своїй іонізованій формі ).
Кислота глутамінова містить не менше 98.5 % і не більше 100.5 % (S)-2-амінопентан-1,5-дикарбонової кислоти, у перерахунку на суху речовину.
Субстанція має відповідати вимогам щодо питомого оптичного обертання, зазначеним у розділі „Випробування на чистоту”.
ВИПРОБУВАННЯ НА ЧИСТОТУ
Розчин S. 1.0 г субстанції при слабкому нагріванні розчиняють у 1 М розчині кислоти хлористоводневої і доводять об’єм розчину тією самою кислотою до 10.0 мл.
Питоме оптичне обертання. (2.2.7; ДФУ I видання, доповнення 2, С. 49) Від + 30.5° до + 32.5°, у перерахунку на суху речовину. Визначення проводять, використовуючи розчин S.
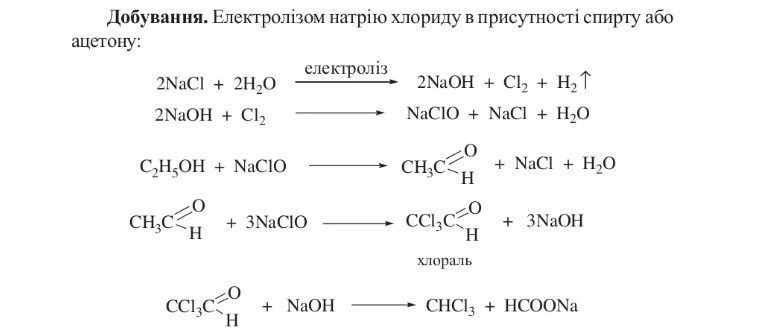
7. Добування хлороформу. Застосування. Умови зберігання.
Хлороформ (трихлорметан) СНСl3 - безбарвна прозора летка рідина з характерним запахом. Змішується з діетиловим етером, етиловим спиртом та іншими органічними розчинниками, слабко розчиняється у воді. Під впливом світла, повітря, вологи i температури хлороформ поступово розкладається. При цьому можуть утворюватися фосген, мурашина та хлоридна кислоти.
Застосування. Дія на організм. Хлороформ широко застосовується в хімічній промисловості та хімічних лабораторіях як розчинник. Раніше його застосовували в медицині для наркозу. Тепер хлороформ у суміші з іншими лікарськими препаратами використовують для розтирань. Пара хлороформу легко проникає в організм з повітря, що вдихається. Хлороформ діє на центральну нервову систему, спричинюючи наркоз. Він накопичується в тканинах, багатих на жири. Якщо хлороформ надійшов в організм у великих кількостях, можуть з'явитися дистрофічні зміни у внутрішніх органах, особливо в печінці. При отруєнні хлороформом смерть настає від зупинки дихання.
Молярна маса – 119,38 г/моль, густина – 1,483 г/см³. Термовластивості: t кристалізації – -63,5 °C, t кипіння – 61,2 °C. Формула: CHCl3.
Зберігання. У добре закупорених склянках з темного скла, у прохолодному місці.
8. Охарактеризуйте броматометричний метод кількісного визначення лікарських засобів на прикладі кислоти саліцилової. Напишіть рівняння
хімічних реакцій, формулу розрахунку масової частки. Визначте молярну масу еквіваленту.
Кислота саліцилова (Acidum salicylicum), саліцилова кислота.
C7H6O3 Мол. м. 138,1
Броматометрія, зворотне титрування, з йодометричним закінченням
До певного об’єму досліджуваного розчину субстанції в колбі з притертим скляним корком додають надлишок стандартного розчину бромід-бромату (0,0167 М розчин калій бромату КBrO3 і калій броміду KBr), кислоти хлоридної Р HCl, закривають корком, витримують протягом 30 хв, періодично струшуючи і залишають на 15 хв.
KBrО3 + 5KBr + 6HCl = 3Br2 + 6KCl + 3H2O
Бром Br2, що виділився, реагує з кислотою саліциловою НОС6Н4СООН з утворенням білого осаду 2,4,6-трибромфенолу і відбувається декарбоксилювання (відщеплення СО2):
1 моль 6 екв.
В реакційну суміш додають кристалічний калйй йодид KI. Не прореагований бром Br2 реагує з калій йодидом KI з утворенням йоду I2:
Br2 + 2KI = I2 + 2KBr
Йод I2, що виділився, титрують стандартним (0,1 М) розчином натрій тіосульфату Na2S2O3 у присутності крохмалю до зникнення синього забарвлення (додають крохмаль під кінець титрування):
I2 + 2Na2S2O3 = 2NaІ + Na2S4O6
I2 + 2е ® 2I–
2S2O32– – 2е ® S4O62–
Паралельно проводять контрольний дослід.
Em(C7Н6О3) = М. м./6
Вміст діючої речовини у субстанції (.перерахунок на суху речовину) у відсотках розраховують за формулою:
%= V( Na2S2O3)-Vосн*K( Na2S2O3)*T*100*Vмір.колби, де Т=С(КВr2O3)*М/1000
m*V
9. Визначити масу наважки кислоти бензойної, якщо на її титрування витрачено 17,05 мл 0,1М розчину гідроксиду натрію (КП = 0,9954), а її відсотковий вміст в лікарському засобі - 99,80%.
| VNaOH - 17,05 мл с NaOH - 0,1 моль/л КП = 0,9954 w - С7Н6О2 - 99,80% | МС7Н6О2 - 112,12 г/моль ТС7Н6О2/NaOH = СNaOH×М (С7Н6О2 )/1000 = = 0,1*112,12/1000 = 0,011212 г/моль м.н.С7Н6О2 = V*K*T = 17,05*0,9954*0,011212 = 0,19 г |
| м.н.С7Н6О2 - ? |
1 2 3